Хлорофил (от гръцки: χλωρός – „зелен“ и φύλλον – „лист“) е зелен пигмент, открит в голяма част от растенията, някои водорасли и зелени гъби. Съдържа се в хлоропластите при висшите и в хроматофорите при низшите растения. При негово участие се извършва фотосинтезата. Количеството му в листата е от 0,6 до 1,2%. Поглъща слънчева енергия и я трансформира в енергия на химичните връзки в органичните съединения, които се синтезират в процеса на фотосинтезата. По химически състав хлорофилът е от групата на органичните съединения. Има сложен химичен състав – представлява белтък[източник?], свързан с магнезий.
Хлорофилът не се разтваря във вода. Свързва се нековалентно с белтъци в пигмент-белтъчни комплекси. Извлича се с помощта на органични разтворители – алкохол, ацетон, бензол, хлороформ.
Хлорофилът поглъща слънчевата енергия най-силно в синята и червената части на видимия спектър.[2] Обратно, в зеления участък на спектъра поглъщането е намалено, а дифузното отражение от стените на клетките е повишено. Затова тъканите, богати на хлорофил, се възприемат от човешкото око като оцветени в зелено.[1] При зелените растения съществуват два типа хлорофил: хлорофил a и хлорофил b.[3]
История
Хлорофилът е изолиран и наименуван за пръв път от французите Жозеф Биенеме Кавенту и Пиер Жозеф Пелетие през 1817 г.[4] Присъствието на магнезий в хлорофила е открито през 1906 г.,[5] което е и първият път, когато магнезий е засечен в жива тъкан.[6]
След първоначална работа, направена от германския химик Рихард Вилщетер в периода от 1905 до 1915 г., общата структура на хлорофил a е изяснена от Ханс Фишер през 1940 г. Към 1960 г., когато по-голямата част от стерохимията на хлорофила a е опозната, Робърт Бърнс Удуърд публикува цял синтез на молекулата.[6][7] През 1967 г. последните останали стереохимични изяснения са завършени от английския химик Иън Флеминг,[8] а през 1990 г. Удуард и екип публикуван обновен синтез.[9] През 2010 г. е обявено, че хлорофил f присъства в цианобактерии и други аеробни микроорганизми, които образуват строматолити.[10][11] Дедуцирани са молекулната формула C55H70O6N4Mg и структурата (2-формил)-хлорофил a.[12]
Фотосинтеза

Хлорофилът е жизненоважен за фотосинтезата, която позволява на растенията да приемат енергия от светлината.[13]
Хлорофилните молекули се подреждат във и около фотосистеми, които са вградени в тилакоидните мембрани на хлоропластите.[14] В тези комплекси хлорофилът служи за три функции. Функцията на по-голямата част от хлорофила (до няколкостотин молекули на фотосистема) е да абсорбира светлина. Правейки това, същите центрове извършват втора функция – да преобразуват светлинната енергия чрез резонантен енергиен трансфер към определена хлорофилна двойка в реакционния център на фотосистемите. Тази двойка влияе върху крайната функция на хлорофила – разделяне на зарядите, водейки до биосинтеза. Идентичността, функцията и спектралните свойства на видовете хлорофил във всяка фотосистема са различни, както е различна и протеиновата структура около тях. Веднъж извлечени от протеина в разтворител (като например ацетон или метанол), тези хлорофилни пигменти могат да се разделят на хлорофил a и хлорофил b.[15][16][17]
Функцията на реакционния център на хлорофила е да абсорбира светлинна енергия и да я прехвърли към други части на фотосистемата. Приетата енергия на фотона се преобразува на електрон в процес, наречен разделяне на заряда. Премахването на електрон от хлорофила е оксидираща реакция. Хлорофилът дава високоенергийния електрон на ред молекулни посредници, което се нарича електрон-транспортна верига. Зареденият реакционен център на хлорофила (P680+) тогава се редуцира към базовото си ниво като приема електрон от вода. Електронът, който редуцира P680+, накрая идва от оксидацията на вода в O2 и H+ чрез няколко посредници. Тази реакция обяснява как фотосинтезиращи организми като растенията произвеждат O2 и са източник на практически всичкия кислород в земната атмосфера.
Потокът от електрони, произведен от реакционния център, се използва за изпомпване на H+ йони през тилакоидната мембрана, установявайки хемиосмотичен потенциал, използван основно при произвеждането на АТФ (съхраняване на химична енергия) или за да редуцира НАДФ+ до НАДФ. НАДФ е универсален агент, използван за редуцирането на CO2 до захари.
Хлорофил-протеиновите комплекси на реакционните центрове са способни директно да абсорбират светлина и да изпълняват разделяне на заряди без помощта на други хлорофилни пигменти, но вероятността това да се случи при даден интензитет на светлината е малка. Следователно с другите хлорофили във фотосистемата всички кооперативно абсорбират и насочват светлинна енергия към реакционния център. Освен хлорофил a, съществуват и други спомагателни пигменти.
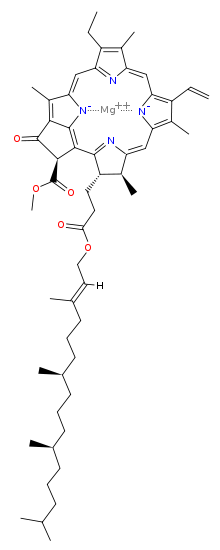
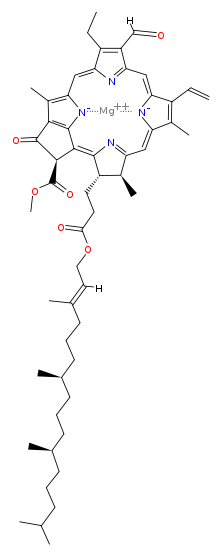
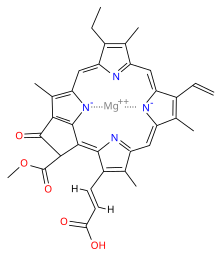
Химична структура
| Хлорофил a | Хлорофил b | Хлорофил c1 | Хлорофил c2 | Хлорофил d | |
|---|---|---|---|---|---|
| Молекулна формула | C55H72O5N4Mg | C55H70O6N4Mg | C35H30O5N4Mg | C35H28O5N4Mg | C54H70O6N4Mg |
| C3 група | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CH=CH2 | -CHO |
| C7 група | -CH3 | -CHO | -CH3 | -CH3 | -CH3 |
| C8 група | -CH2CH3 | -CH2CH3 | -CH2CH3 | -CH=CH2 | -CH2CH3 |
| C17 група | -CH2CH2COO-Phytyl | -CH2CH2COO-Phytyl | -CH=CHCOOH | -CH=CHCOOH | -CH2CH2COO-Phytyl |
| C17-C18 връзка | единична | единична | двойна | двойна | единична |
| Разпространение | навсякъде | повечето растения | някои гъби | някои гъби | цианобактерии |
 |
 |
 |
 |
 |
Кулинарна употреба
Хлорофилът е регистриран като хранителна добавка (оцветител) и Е-номер е Е140. Готвачите използват хлорофил, за да оцветяват различни храни или напитки в зелено, като например паста и абсент.[18] Хлорофилът е неразтворим във вода и затова първо се смесва с малко количество растителна мазнина, за да се получи желания разтвор.
Източници
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.


