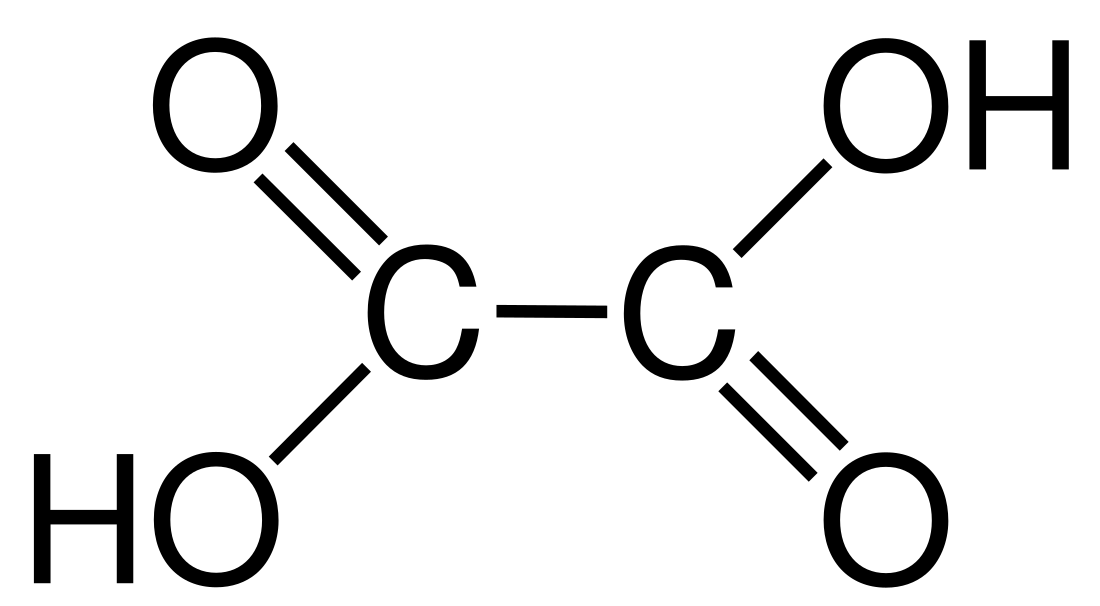
Oksaalsuur is 'n organiese verbinding met die formule (COOH)2 (of C2H2O4). Dit het 'n molekulêre struktuur met twee karboksielsuur-groepe en dit is die eenvoudigste dikarboksielsuur. Sy soute heet oksalate.
|
Algemeen | |
|---|---|
| Naam | Oksaalsuur |
| Ander name | etaandikarboksielsuur |
 |
 |
| Chemiese formule | (COOH)2(.2H2O) |
| Molêre massa | 1126,07 g/mol (dihidr.) |
| CAS-nommer | 144-62-7 (anhidraat)[1] 6153-56-6 (dihidraat)[2] |
| Voorkoms | Kleurlose, wit kristalle; anhidraat higroskopies |
| Fasegedrag | |
| Smeltpunt | 189,5 (anhid.), 101 (dihidr.) |
| Kookpunt | ontbind 157 (dihidr) |
| Digtheid | 1,653 g/cm3 (dihidr.) |
| Oplosbaarheid | |
|
Suur-basis eienskappe | |
| pKa | 1,23 (1ste), 4,19 (2de) |
|
Veiligheid | |
| Flitspunt | |
| LD50 | 7500 mg/kg (rot; oraal) |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Suiwer oksaalsuur is 'n vastestof wat taamlik higroskopies is. Dit word gewoonlik as die dihidraat (COOH)2.2H2O verkoop. Dit is 'n wit kristallyne vaste stof wat 'n kleurlose oplossing in water vorm. Die suursterkte daarvan is baie groter as die van asynsuur. Oksaalsuur is 'n reduseermiddel[3] en sy gekonjugeerde basis, bekend as oksalaat (C2O2−4), is 'n cheleermiddel vir metaalkatione.
Oksaalsuur kom in talle natuurprodukte voor soos rabarber en spinasie. Een tipe nierstene bestaan uit 'n neerslag van kalsiumoksalaat.
Geskiedenis
Die bereiding van soute van oksaalsuur vanuit plante was bekend sedert 1745, toe die Nederlandse botanikus en dokter Herman Boerhaave 'n sout van uit die plant Oxalidaceae geïsoleer het.[4] Teen 1773 het François Pierre Savary van Fribourg, Switserland oksaalsuur van die sout in hierdie plante geïsoleer.[5]
In 1776 het die Sweedse chemici Carl Wilhelm Scheele en Torbern Olof Bergman[6] oksaalsuur vervaardig deur suiker met gekonsentreerde salpetersuur te laat reageer; Scheele het die suur wat tot gevolg gehad het, suikersuur genoem. Teen 1784 het Scheele aangetoon dat suikersuur identies was aan oksaalsuur uit natuurlike bronne.[7]
In 1824 het die Duitse chemikus Friedrich Wöhler oksaalsuur verkry deur sianogeen met ammoniak in waterige oplossing te laat reageer.[8] Hierdie eksperiment verteenwoordig moontlik die eerste sintese van 'n natuurlike produk.[9]
Gebruike
Een kwart van die geproduseerde oksaalsuur sal as kleurmiddel gebruik word in kleurprosesse. Dit word in bleikmiddels gebruik, veral vir pulphout. Dit word ook in bakpoeier[3] en in silika-analise-instrumente gebruik.
Die belangrikste toepassings van oksaalsuur is skoonmaak of bleiking, veral vir die verwydering van roes. Die nut daarvan in roesverwyderingsagente is te danke aan die vorming van 'n stabiele, wateroplosbare sout, 'n ferrioksalaatioon.
Oksaalsuur is 'n belangrike reagens in lantaniedchemie. Gehidreerde lantaniedoksalate vorm geredelik in baie sterk suuroplossings in 'n dig kristallyne, maklik gefiltreerde vorm, grootliks vry van besoedeling deur nie-lantanied elemente. Die termiese ontbinding van hierdie oksalaat gee die oksiede, wat die mees algemene bemarkingsvorm van hierdie elemente is.

Oksaalsuur word deur sommige byeboere gebruik as 'n gif teen die varroa-parasiet.[10]
Oksaalsuur word soms gebruik in die aluminium-anodiseringsproses, met of sonder swaelsuur. In vergelyking met die anodisering van swaelsuur, is die bekleding dunner en vertoon dit 'n laer oppervlakruwheid.
Kyk ook
Verwysings
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.