来自维基百科,自由的百科全书
拉塞福模型(Rutherford model)是新西兰物理学家歐尼斯特·拉塞福創立的原子模型。1909年,拉塞福領導設計與完成拉塞福散射實驗,其證實了在原子中心部分有一個帶正電、帶質量的原子核,因此約瑟夫·湯姆孫主張的葡萄乾布丁模型被推翻。拉塞福根據他的實驗結果設計出一種新模型,稱為「拉塞福模型」,其擁有幾個重要的特色:大多數的質量和正電荷,都集中於位於中心區域、半徑極小的原子核,而電子則環繞在原子核的外面。拉塞福模型是一種核子模型,在拉塞福散射實驗裡,主角是原子核,而電子並不重要,因此拉塞福不能空口無憑地給出電子的排列方式,也無法用這模型對於化學結合、元素列表、原子譜線給出解釋。[1][2]:51-53[3]:14
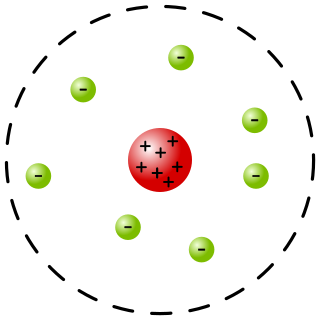

拉塞福散射實驗使用阿爾法粒子來探測原子的結構。1909年,在恩師拉塞福的指導下,漢斯·蓋革和欧内斯特·马斯登發射阿爾法粒子射束於白金箔紙。[註 1]在那時代,原子被認為類比於梅子布丁(物理學家湯姆森提出的),負電荷(梅子)分散於正電荷的圓球(布丁)。假若這梅子布丁模型是正確的,由於正電荷完全散開,而不是集中於一個原子核,庫侖位勢的變化不會很大,通過這位勢的阿爾法粒子,其移動方向應該只會有小角度偏差。[4][2]:51-53
然而,他們得到的實驗結果非常詭異,大約每8000個阿爾法粒子,就有一個粒子的移動方向會有很大角度的偏差(超過90°);而其它粒子都直直地衝過白金箔紙,[註 1]沒有任何偏差。從這結果,拉塞福斷定,大多數的質量和正電荷,都集中於一個很小的區域(原子核);電子則包圍在區域的外面。當一個(正價)阿爾法粒子移動到非常接近原子核,它會被很強烈的排斥,以大角度反彈。原子核的小尺寸解釋了為什麼只有少數的阿爾法粒子被這樣排斥。從純屬對稱性和審美性的觀點,這個質量與電荷集中的區域,應該處於原子中心。[4][2]:51-53
1911年,拉塞福提出他自己的物理模型,詮釋這些突如其來的答案。原子,是由一個帶正電荷的中心區域(這就是現代的原子核,雖然拉塞福沒有想到這術語),和環繞在這區域外面的電子雲,所構成的。[5][2]:51-53[2]:51-53
從能量守恆定律,拉塞福推理,知道阿爾法粒子的速度,就可以知道阿爾法粒子的撞擊能夠達到與原子核的最小距離。稍加計算,他得到金原子的原子核半徑必小於(真實值只是這數值的五分之一)。金原子的半徑大約是。這是一個令人驚訝的結果,所有的正電荷都聚集於原子中心一個很小區域,其半徑小於三千分之一原子半徑!
拉塞福模型並沒有給予電子的環繞運動任何結構。拉塞福在1911年論文裏,提到了長岡半太郎的半太郎模型。長岡半太郎建議電子的軌道就像土星環,這是從詹姆斯·馬克士威的土星環穩定理論獲得的靈感。[6][7]:22-23
拉塞福更進一步地建議原子中間的單位電荷數目可能與其原子量成比例(大約一半)。那時,金的原子量估計為 197 amu。所以,拉塞福猜想單位電荷數目是98個單位電荷左右。這數子與金原子的原子序79(那個年代,在週期表的位置次序)相差甚遠,拉塞福並沒有正式地建議兩個數量可能完全一樣。
很快地,學者們發覺拉塞福模型,雖然擁有一些引人欣賞的性質,但也引起一個很嚴重的問題。由於拉塞福不能空口無憑地給出電子的排列方式,也無法用這模型對於化學結合、元素列表、原子譜線給出解釋。為了解決這問題,必須彌補拉塞福模型的不足,因此,尼爾斯·波耳認為必須明確設計出電子的軌域運動規則,他發表了波耳模型。不久以後,拉塞福模型就被更為先進的波耳模型取代了。這模型引用了一些早期量子力學的實驗結果來設定電子的物理行為,限制電子的軌道為平面的圓形軌道。將亨利·莫塞萊的研究結果加以延伸,波耳認為,原子核的單位電荷數目與原子序有直接的關係。[2]:53-57由於波耳模型是拉塞福模型的改良,有些物理學書本將兩個模型合併,將波耳模型稱為「拉塞福-波耳模型」。
Seamless Wikipedia browsing. On steroids.