多发性硬化症
来自维基百科,自由的百科全书
多發性硬化症(multiple sclerosis,MS)或多发性脑脊髓硬化症(multiple cerebrospinal sclerosis[8]),是一種以中枢神经系统白质炎性脱髓鞘病变为主要特点的自身免疫疾病,因病变具有部位(空间)多发和时间多发的特点,且产生许多硬性的胶质瘢痕(glial scar)而得名。
| 多發性硬化症 | |
|---|---|
| 异名 | 瀰漫性硬化症、瀰漫性腦脊髓炎 |
 | |
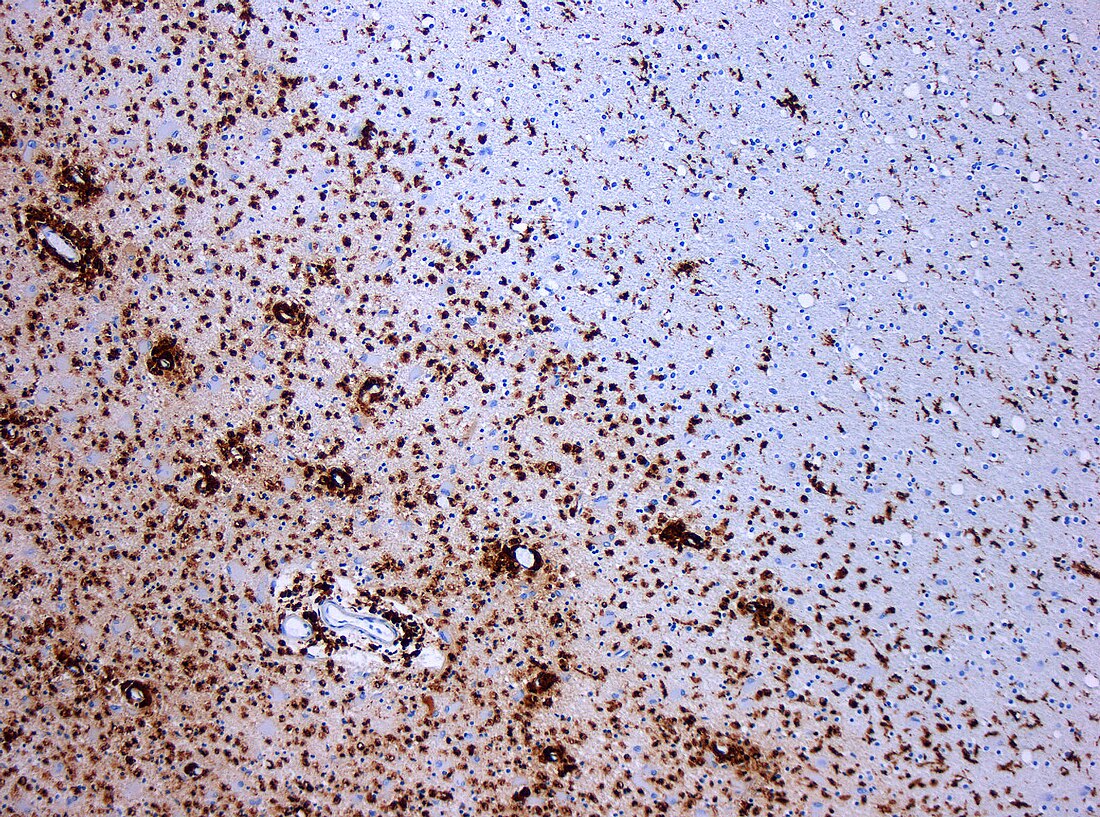
| CD68標記的組織病理切片。CD68是一種巨噬细胞的表面標記,多發性硬化症造成的脫髓鞘性病灶附近常可以看到許多CD68+的巨噬細胞存在。 | |
| 症状 | 複視、單側視力受損、肌肉無力、感覺受損、協調障礙[1] |
| 起病年龄 | 20–50歲[2] |
| 病程 | 慢性[1] |
| 类型 | 脫髓鞘病[*]、中枢神经系统脱髓鞘病[*]、中枢神经系统自体免疫性疾病[*]、疾病 |
| 病因 | 未知[3] |
| 診斷方法 | 基於症狀和醫學檢驗[4] |
| 治療 | 藥物、物理治療[1] |
| 预后 | 預期餘命減少5-10年[5] |
| 患病率 | 200萬分之一(2015)[6] |
| 死亡數 | 18,900(2015)[7] |
| 分类和外部资源 | |
| 醫學專科 | 神經內科 |
| ICD-11 | 8A40 |
| ICD-9-CM | 340 |
| OMIM | 612594、612596、612595 |
| DiseasesDB | 8412 |
| MedlinePlus | 000737 |
| eMedicine | 1146199、1214270、342254 |
多發性硬化症最常侵犯的部位是脑室周围白质、视神经、脊髓、脑干传导束和小脑白质等处。患者腦或脊髓中的神經細胞表面的絕緣物質(即髓鞘)受到破壞[1],神經系統的訊息傳遞受損,導致一系列可能發生的症狀,影響患者的活動、心智、甚至精神狀態[5][9][10]。
多發性硬化症依损害部位不同而临床表现多样,常见表现有视力下降(複視、單側視力受損)、感觉异常或遲鈍、肢体无力、共济失调或協調障礙、大小便障碍等[1]。
病情多變,病程中常有缓解与复发、继发与进展,也可能初次發病後持續加劇。在每次發作之間,症狀有可能完全消失,但永久性的神經損傷仍然存在,這在病情嚴重的患者特別明顯[11]。
雖然具體的成因不明,但多發性硬化症的機制可能為髓鞘受到免疫系統破壞或生成髓鞘的細胞發生問題[3],可能的原因包括遺傳與環境因素,例如受病毒感染的刺激而引發自體免疫反應[9][12]。多發性硬化症的診斷需藉助臨床表現和相關的影像學證據支持[4]。
目前尚無根治多發性硬化症的方法[1],現有的治療多為改善患者發作後的日常功能,並預防疾病再度復發[9]。物理治療則能改善患者的功能[1]。許多人會尋求替代疗法,儘管其療效缺乏證據支持[13]。多發性硬化症的長期預後很難預測,通常女性、較年輕發作、反覆復發緩解(relapsing-remitting)和一開始發作次數較少的患者有較佳的預後[14]。患者的預期壽命較一般人少5至10年[5]。
多發性硬化症是最常見的中樞神經系統免疫疾病[15]。2015年全球約有230萬人罹患此病,但不同地區和族群的盛行率差異極大[6][16];同年,約有18,900人死於多發性硬化症,相較於1990年的12,000人高出許多[7][17]。多發性硬化症通常在20到50歲之間發病,女性的發生率為男性的2倍[2]。1868年,让-马丁·沙可首次描述了多發性硬化症,意指大腦白質和脊髓中有許多疤痕(sclerae,可理解為現在所稱的斑塊或病灶)[18][19]。多種新的治療與診斷方法都正在研究當中[20]。
症狀

多發性硬化症患者可能出現任何神經學症狀,其中自主神經、視覺、運動和感覺問題最常出現[5]。確切的症狀則依患者病灶的實際位置而異,可能有感覺喪失或感覺異常(如刺痛感或麻木等)、肌肉無力、視力模糊[21]、反射增強、痙攣或運動困難、無法維持協調與平衡(共济失调)、發音困難或吞嚥障礙、視覺問題(如眼球震颤、視神經炎或複視)、疲勞、急性或慢性疼痛、膀胱與腸胃蠕動問題等等,思考障礙或情緒問題(如憂鬱症或情緒不穩)也很常見。烏托夫現象(Uhthoff's phenomenon,溫度較高時症狀較嚴重)和萊爾米特徵候(Lhermitte's sign,即把頸部前彎時會感到一股電流傳到背上)則是多發性硬化症典型的徵候[5]。扩展残疾状态量表(EDSS)是用來量化疾病嚴重度和患者失能程度的主要指標,其他指標如多發性硬化症功能複合量表也越來越常用於研究中[22][23][24]。
約85%的患者一開始僅出現臨床單一症狀(CIS,即發生一次疑似多發性硬化症的發作),幾天後45%的患者未出現運動或感覺問題、20%有視神經炎、10%有和腦幹相關的症狀,剩下的25%則有超過一種前述的問題[4]。症狀最初通常以兩種形式出現:患者可能會有幾次持續數天到數個月的急性惡化並隨後改善(85%);也可能緩慢逐漸惡化而沒有任何好轉的跡象(10–15%)[2];病程也可能混合上述兩種形式[11],或一開始會發作和改善,但之後卻轉為持續惡化[2]。症狀的發作通常沒有徵兆,因此難以預測,但很少一年超過兩次[5]。然而有些患者的發作會受特定因素刺激,因此在春夏較常出現[25]。同樣地,病毒感染(如感冒、流行性感冒或腸胃炎)也會增加風險[5],壓力也可能引起疾病發作[26]。 患有多發性硬化症的婦女在懷孕後會較少發作,但生產後的頭幾個月發作風險會增加;整體而言,懷孕不會影響長期預後。目前已知許多因素都不會影響多發性硬化症的復發率,包括接種疫苗、餵乳[5]、身體創傷[27]和烏托夫現象(Uhthoff's phenomenon)[25]。
病因
多發性硬化症的病因未明,但一般相信是由遺傳和環境因素(如感染)共同造成[5]。有許多理論試圖將臨床資料和假說相結合,但仍沒有確切的答案。雖然目前已知有若干環境風險因子是能透過人為改善的,但消除此類環境因子是否能預防多發性硬化症還有待進一步研究[28]。
多發性硬化症在緯度較高的地區較常出現[5][29],但此分佈也有例外。某些住在高緯地區的種族盛行率較低,例如萨米人、美洲原住民、加拿大胡特爾人、紐西蘭毛利人[30]和加拿大因纽特人[2];某些住在赤道附近的族群盛行率則相對較低,例如薩丁尼亞人[2]、西西里人[31]、巴勒斯坦人和帕西人[30]。造成此種地理分布的原因未知[2],雖然目前南北分布差異逐漸縮小[29],但到2010年為止仍然存在[2]。
多發性硬化症在北歐族群較常見[5],這反映了此類高風險族群的全球分布狀況[2],部分學者認為這和高緯地區陽光照射較少導致體內維生素D較少有關[32][33][34]。出生季節和多發性硬化症的關聯支持前項假說,北半球十一月出生的人相較於五月出生的人較容易發生多發性硬化症[35]。兒童時期的環境因子可能也有重要的影響,一些研究發現15歲前移居其他地方居住的孩童適用於移居處的發病率;但若15歲以後才搬家,則風險與其家鄉較為相近[5][28]。其他證據則顯示15歲以後移居仍會對罹病風險產生影響[5]。

普遍不認為多發性硬化症是一種遺傳疾病,但一些遺傳變異可能會增加罹病風險[36],有些此類的基因在微膠細胞中似乎有超乎預期的表現量[37]。患者的親屬罹患多發性硬化症的機率較一般人高,血緣關係親近者風險更高[9];同卵雙胞胎的另一人約有30%的罹病率,而異卵雙胞胎則只有5%,手足更只有2.5%,同父異母或同母異父的手足機率更低[5][9][38]。若雙親都有多發性硬化症,則孩童的發生率為一般人的十倍[2]。此外,特定族裔的盛行率也比較高[39]。
目前已發現許多和多發性硬化症有關的基因,其中就包括了人類白細胞抗原(HLA),這是一群在第六染色體上作為主要組織相容性複合體(MHC)的蛋白質[5]。HLA和多發性硬化症之間的關聯最初在1980年代發現,現在該區域已證實和其他自體免疫疾病(如1型糖尿病和全身性紅斑狼瘡)有關[40]。目前已知和多發性硬化症最有關的MHC等位基因為DR15和DQ6,另有些基因座如HLA-C554和HLA-DRB1*11似乎對多發性硬化症有保護作用[5]。整體而言,HLA的改變對多發性硬化症貢獻了20%至60%的遺傳傾向。透過現代的遺傳學方法(如全基因組關聯分析),科學家已發現其他至少12個HLA基因座以外的基因可能會增加多發性硬化症的罹病率[40]。
科學家曾提出多種微生物可能會誘發多發性硬化症,但沒有一種獲得證實[9]。早年就移居到世界上的其他地方會改變之後罹患多發性硬化症的風險,針對這種現象的一種解釋是移居地可能會有原住居處少見的感染症[12];其他解釋則有衛生假說和盛行假說。衛生假說認為在生命早年暴露於特定的感染源能增強個體的保護力,若長大後才接觸那些病源則會造成疾病[5]。盛行假說則認為多發性硬化症是由盛行地區某種感染源造成,但多數受感染的人沒有症狀,只有少數個案在數年後才真的造成脫鞘病變[12][41]。目前衛生假說較盛行假說獲得更多支持[12]。
多數多發性硬化症的患者腦和腦脊髓液中含有寡株落條帶,部分研究者認為這可能是病毒感染的證據,該現象也會出現在某些人類病毒性脫鞘性腦脊髓炎和動物的病毒性脫鞘性疾病[42]。目前懷疑人類皰疹疹病毒是最可能的感染源[43]。未曾被EB病毒感染的人罹患多發性硬化症的機率較低,但在成人早年受感染的人比更年輕就被感染的人有更高的罹病風險[5][12]。有些學者認為此項假說和衛生假說抵觸,因為未受感染的人可能有較好的衛生教育[12];其他學者則相信兩者並不衝突,因為相較於衛生假說中的早期感染源,患者是在生命較後期才接觸到刺激多發性硬化症的病源菌。其他相關的病毒感染可能還包括麻疹、腮腺炎和德國麻疹[5]。
目前已知吸菸是多發性硬化症的一個獨立風險因子[32]。壓力也可能會增加罹病風險,但相關的證據較為薄弱。職業毒物暴露(主要為有機溶劑)的影響也曾受評估,但沒有明確的結果。以往的研究對疫苗接種做過因果分析,但多數沒有找到關聯性[28]。其他可能的風險因子(如飲食和賀爾蒙攝取)也曾被科學家檢視,但這些因素和多發性硬化症間的關係都較薄弱且缺乏說服力[32]。多發性硬化症的患者罹患痛風的比率較低,血中的尿酸濃度也較低;因此有假說認為尿酸對多發性硬化症有保護作用,但目前對於尿酸扮演的角色仍屬未知[44]。
病生理學


多發性硬化症發生的三個重要特徵包含出現中樞神經系統病灶、發炎反應,以及髓鞘破壞等。關於上述特徵如何出現,以及這些機轉如何導致臨床症狀,目前尚未完全了解[5]。目前相信膽固醇結晶會導致髓鞘破壞,並加強發炎反應[45][46]。多發性硬化症目前認為是一種免疫發炎引起的疾病,意即疾病乃是因個體的免疫系統引起的發炎反應破壞了神經系統。可能是遺傳或其他尚未證實的環境因子使然[9]。

多發性硬化症會造成受侵犯的神經病灶處產生疤痕,並以此得名。本疾病最常進犯視神經、腦幹、基底核、脊髓,以及側腦室周圍的白質[5]。白質主要由神經纖維構成,負責傳遞灰質腦區間的信息。多發性硬化症較少侵犯周邊神經系統[9]。
更精確一點來說,多發性硬化症會造成寡突膠質細胞的喪失。寡突膠質細胞會產生和維持包覆神經纖維的髓鞘,幫助動作電位的傳導[5];若寡突膠質細胞受到進犯,可能會導致髓鞘消失或變薄,甚至使神經元的軸突受損退化。髓鞘消失後,神經元的傳導效率會下降[9],因此寡突膠細胞會啟動再髓鞘化的程序修復髓鞘。這種修復現象可以疾病初期看到,但寡突膠的修復能力並無法完全重建髓鞘。若髓鞘反覆受損,再髓鞘化的效能會逐漸下降,最後導致受損軸突周圍堆滿了疤痕狀的斑塊[47]。這些疤痕會導致多發性硬化症的症狀。在症狀發作時,磁振照影(MRI)時常會顯示腦部出現十幾個新斑塊。這種現象可能代表患者腦部其實存在有大量的病灶,但因為神經的自癒功能,使患者平時沒有出現明顯症狀。另外,病灶處也會因為神經損傷而導致星狀細胞異常增多[5]。目前有許多關於多發性硬化症的病理特徵已經被描述[48]。
除脫髓鞘現象外,發炎反應也是多發性硬化症的重要體徵之一。T細胞在多發性硬化症的發炎反應中扮演重要角色[9],平時中樞神經系統會受到血腦障壁保護,一旦這層屏障受到破壞,T細胞就會進到中樞神經,將髓鞘視為外來物進行攻擊,這些攻擊自身的淋巴細胞又稱自體反應性淋巴球(autoreactive lymphocytes)[5]。髓鞘遭受攻擊後會誘發免疫反應的產生,使免疫細胞釋放細胞激素和抗體,擴大發炎反應。持續擴大的發炎反應可能會導致血腦障壁的瓦解,進而出現一系列神經受損的現象,例如神經水腫、巨噬細胞活化、細胞激素釋放,以及出現許多遭受破壞的蛋白質[9]。發炎反應也會透過至少三種途徑影響訊息的傳導,發炎介質會阻滯周圍正常神經的信息傳遞,另外髓鞘的破壞也會減少神經信息的傳遞效率[5]。
血腦障壁是中樞神經系統血管外一層防止血液中的物質進入腦脊髓的屏障,同時也能阻擋T細胞進入。但如果中樞神經遭到病毒或細菌感染時,血腦障壁的通透性會增大。感染消退後,血腦障壁會自行修復,但當初跑進來的T細胞會殘留在腦中[9]。钆是一種沒有辦法穿透正常血腦障壁的元素,因此钆增強磁振造影(gadolinium-enhanced MRI)可以用於檢測血腦障壁瓦解與否[49]。
診斷


臨床症狀是診斷多發性硬化症的重要依據,配合醫學影像和醫學檢驗可以輔助診斷[4]。但症狀常與其他疾病類似,造成診斷較為困難,特別是在疾病初期[5][50]。麥克唐納診斷標準(McDonald criteria)是目前最常使用的診斷工具,該標準收錄了臨床、檢驗,以及放射醫學的證據[16]。舒馬克和波色診斷標準是過去常用的診斷標準,但已被麥氏標準取代[51]。惟2010年的麥氏標準在部分疾病的診斷描述上,與其他疾病重疊(如泛視神經脊髓疾病等),因此2016年,歐洲多發性硬化症核磁共振影像學會連線(European Magnetic Resonance Imaging in Multiple Sclerosis,MAGNIMS)提出了MAGNIMS共識,加入影像學的判斷,為麥式標準的內容進行修訂[52]。
若患者有多次特異性較高的事件發作,可能直接透過臨床證據即可診斷多發性硬化症。但若僅有發作過一次,則必須進行其他測試來輔助診斷。最常見的工具有神經影像學、腦脊髓液分析,以及誘發電位測試。核磁共振影像可以顯示腦部喊脊隨脫髓鞘的區域,以及斑塊等病灶。靜脈輸注含钆的顯影劑可以標定活躍斑塊,且也可以顯影無症狀性的斑塊病灶[53][54]。腦脊髓液分析可以顯示中樞神經系統是否存在慢性發炎,需透過腰椎穿刺採檢取得。技術員會將腦脊液進行電泳,檢視電泳膠片上是否帶有IgG的寡克隆條帶(oligoclonal band),75–85%的多發性硬化症患者的腦脊液分析可以找到特徵[53][55]。此外,由於脫髓鞘現象,患者的視神經和感覺神經對於刺激的敏感度也會下降,這些現象可以透過視神經和感覺神經的誘發電位偵測而得[56]。
上述的診斷方式皆屬於非侵入性的診斷方式[5],但有時必須透過遺體解剖和病灶的組織活檢才能確診[53][57]。截至目前為止,尚無單一檢驗(包括組織活檢)可以確診多發性硬化症[58]。
分型
截至2013年為止,美國國家多發性硬化症學會(National Multiple Sclerosis Society)和國際多發性硬化症聯合會(Multiple Sclerosis International Federation)已描述了四種分型。分型有利於從過去病史推斷為來的預後,且對未來的治療策略也有重要意義[59][60][61]:
- 臨床單一症候群(Clinically isolated syndrome,CIS)
- 復發緩解型多發性硬化症(Relapsing-remitting MS,RRMS)
- 原發進行性多發性硬化症(Primary progressive MS,PPMS)
- 續發進行性多發性硬化症(Secondary progressive MS,SPMS)
復發緩解型(RRMS)多發性硬化症中最常見的一型,占所有首次發作病患的80%左右。此類患者在單次發作後,會進入數月到數年的緩解期,在此期間病患的症狀會相對穩定,但在之後會無預期性地復發。每次發作後所造成的神經功能缺損可能會幾乎緩解,但也有約40%的病人會有後遺症,且發作時間越久,發生後遺症的機會越大[5][4]。由於此類患者在發作後會緩解,有時又被視為「良性多發性硬化症」(benign MS)[62],但長期下來,患者的神經損傷仍然會累積,最終導致神經功能退化[5]。另一方面,所謂「惡性多發性硬化症」則是描述在短期即會造成神經功能明顯減退的類型[63]。臨床單一症候群(CIS)是描述病人發生一次疑似脫髓鞘的症狀,但尚未符合多發性硬化症的診斷標準[5][64]。約有30-70%的CIS最後會進展為多發性硬化症,而RRMS大多也會以CIS最為其初始表現[64]。
原發進行性多發性硬化症(PPMS)約占多發性硬化症患者的10–20%,此類患者在初始發作後,症狀即會不斷惡化,完全不會緩解或改善[11][4][65]。此類病人會較復發緩解型晚發病。復發緩解型和續發進行性大約都是在40歲左右發病[5]。雖然此類病人的表現與RRMS有極大差異,但期病程進展速度其實大致相同[66]。
續發進行性(SPMS)常以RRMS作為初始表現,約有65%初始診斷為RRMS的病患為SPMS。此類型的特點是在每次發作之後,神經功能都會有所減退,且之間沒有明顯的緩解期[5][11]。此類患者的症狀偶爾會再發或輕微緩解[11]。一般來說,RRMS會進展到SPMS之間常會間隔19年左右[67]。
除了上述四種類型之外,還有多種疑似多發性硬化症的亞型也已被描述,這些亞型被統稱為特發性發炎性脫髓鞘病。如視神經脊髓炎、瀰漫性脫髓鞘硬化症、同心圓性硬化症、馬爾堡多發性硬化症。目前關於這些疾病是否真的屬於多發性硬化症仍有爭議[68]。兒童多發性患者的表現與成人不同,其進展到進行期(progressive stage)的速度較慢,不過仍然會在一般成人達到進行期的平均年齡之前[5]。
治療
雖然目前無法治癒多發性硬化症,但部分療法已被證實能有效控制疾病。治療的目標為恢復患者的功能、預防再次發作和失能。一般會建議有發作過一次並有兩處以上MRI病灶的患者開始使用藥物介入[69]。就如同其他許多藥物一樣,多發性硬化症的治療可能會帶來一些副作用。人們也不斷嘗試另類療法,即便這些療法的效果缺乏證據支持[13]。
在患者症狀發作時,通常會靜脈注射高劑量類固醇(如甲基培尼皮質醇)[5],口服類固醇似乎也有類似的效果和安全性[70]。整體而言,雖然類固醇能暫時緩解症狀,但似乎對長期預後沒有顯著影響[71]。而對類固醇沒有反應的嚴重發作則可考慮以血漿置換術治療[5]。
截至2019年,已有11種藥物核准用於復發緩解型多發性硬化症的疾病調節,這些药物分別為干擾素β-1a、干擾素β-1b、醋酸格拉替雷 (glatiramer acetate)、米托蒽醌(mitoxantrone)、那他珠單抗(natalizumab)、芬戈莫德(fingolimod)、特立氟胺(teriflunomide)[72][73]、富馬酸二甲酯(dimethyl fumarate)[74]、阿侖單抗(alemtuzumab)[75][76]、奥美珠单抗(ocrelizumab)[77],和西普尼莫德(siponimod)[78]。
截至2012年,藥物治療的成本效益仍然未明[79]。2017年3月,美国食品药品监督管理局(FDA)核准奥美珠单抗用於治療復發緩解型,該藥物為一種抗CD20的人源化單株抗體[80][81],仍有多項第四期臨床試驗進行中[82]。
減少發作次數對於復發緩解型的病程有一定的效果[72]。目前的第一線治療為干擾素和格拉替美[4],兩者大約皆可減少復發機率30%左右[83],且成人跟兒童的效果大致相仿[84]。提早開始長期治療的療程可以改善預後,且安全性無虞[85][86]。那他珠單抗降低復發機會的效果,比起第一線治療更加顯著。但因為擁有一些副作用,因此做為第二線療法,用於對其他療法反應不佳[4],或擁有嚴重不良反應的病人[83]。米托蒽醌的使用受制於嚴重的不良反應,因此目前歸為第三線治療,用於對前兩線治療反應不佳的病人[4]。臨床單一症候群(CIS)用干擾素治療可以減少病人進展為多發性硬化症的機率[5][87]。截至2011年,芬戈莫德、特立氟胺,以及富馬酸二甲酯等較新藥物的效果尚未明朗[88]。
截至2017年,儘管利妥昔單抗(rituximab)尚未核准用於多發性硬化症的治療,但臨床上仍常用於治療復發緩解型多發性硬化症[89]。
2017年以前,利妥昔單抗(rituximab)廣泛被作為原發進行性多發性硬化症的仿單標示外治療[89]。2017年3月,美國食品藥品監督管理局(FDA)核准了奥美珠单抗(ocrelizumab),使之成為第一個核准用於治療原發進行性多發性硬化症的藥物[80][81],美國FDA並要求對該藥物進行若干第四期臨床試驗[82]。
截至2011年[update],米托蒽醌(mitoxantrone)是唯一一種核准用於治療續發進行性多發性硬化症的藥物[90]。在這些患者中,目前的證據暫時支持蒽醌 I能適度緩解疾病惡化,並減少兩年內發作的機率[91][92]。

干擾素及格拉替美(glatiramer)等疾病調節劑最常見的副作用之一是注射處紅腫(皮下注射90%機率,肌肉注射33%機率)。且注射一段時間後,注射處的脂肪組織會崩解,形成一個明顯的凹痕,此現象稱為脂萎縮(lipoatrophy)[93]。干擾素還可能會造成類似流行性感冒的症狀[94]。有些人注射格拉替美後產生的潮紅、胸悶、心悸,和焦慮,通常這些現象不會持續超過30分鐘[95]。疾病調節劑還有其他更危險但罕見的副作用,如干擾素有造成肝損傷的風險[96];米托蒽醌則有可能造成心臟收縮問題(12%)、不孕,以及急性骨髓性白血病(0.8%)等問題[91][97];那他珠單抗則有機會造成进行性多灶性白质脑病(PML,1/600人)[4][98]。
芬戈莫德(Fingolimod)可能導致高血壓、心率下降、黃斑部水腫、肝指數上升,或淋巴球減少[88]。目前證據傾向支持短期使用芬戈莫德似乎安全,常見副作用包含頭痛、疲倦、惡心、脫髮,和四肢疼痛[72]。更嚴重的不良反應包含肝衰竭、进行性多灶性白质脑病,以及致畸性都曾有報導[88]。富馬酸二甲酯的常見副作用為潮紅和腸胃道副作用[74][88]。馬酸二甲酯還可能會導致白血球數量減少,但目前試驗並無伺機性感染的報導[99][100][101]。
藥物和神經復健都可以改善部分症狀,但兩者皆無法逆轉病程[102]。有些症狀如膀胱功能失調和痙攣等症狀對藥物有顯著效果,但其他症狀的效果就相對不佳。其他神經學症狀需依賴科際合作來改善病人的生活品質。由於多發性硬化症的病程及醫療涉及多項醫學專科,因此難以界定所謂的「核心團隊」[5]。良好的科際整合復健計畫可以增進患者的活動功能(activity)和參與功能(participation),但對改善患者的身體功能損傷沒有助益[103]。目前關於個別治療計畫的效果證據有限[104][105],但有良好證據顯示運動[106][107]和心理治療對疾病有些幫助[108]。認知行為療法則顯示對於多發性硬化症造成的疲憊症狀有所助益[109]。
超過50%的多發性硬化症患者會尋求替代醫療(此比率依替代醫療的定義而有差異),但替代醫療的療效通常證據薄弱或缺乏證據支持[13][110]。這些未經驗證的療法包括飲食補充與配方[13][111][112]、維生素D[113]、瑜珈等放鬆技巧[13]、草藥(包括医用大麻)[13][114][115]、高壓氧治療[116]、自行吞下鉤蟲、區域反射療法、针灸[13][117]和正念療法[118]。採用這些療法的患者以女性、長時間罹病、失能嚴重或對常規醫療滿意度低的患者較多[13]。
血管外科醫師保羅·贊博尼在2008年提出了慢性腦脊髓靜脈回流不足(CCSVI)假說,認為多發性硬化症和腦部的靜脈狹窄有關。因此推行血管手術試圖改善多發性硬化症。但後來研究發現手術介入並無任何效益[119],且徒增副作用及死亡風險[120],因此不建議進行[119]。
預後

32-68
68-75
77-77
77-88
88-105
106-118
119-119
120-148
151-462
470-910
多發性硬化症的病程取決於疾病的亞型、個人的性別與年齡、最初的症狀和患者失能的程度。女性、復發緩解型、一開始有視神經炎或感覺症狀、最初幾年較少發作、較早發病的患者有較好的預後[14][121]。
發病後的平均預期餘命為30年,較未得病的群體少了5到10年[5]。接近40%的患者能活到七十幾歲[121],但三分之二的死亡直接與此疾病相關[5]。患者的自殺率也較高,對肢體障礙的患者而言感染和其他併發症的風險則特別高[5]。
約有80%的多發性硬化症患者一開始是以臨床單一症候群表現。若核磁共振掃描發現未進犯的神經區域有異常的影像學變化,在未來兩年內有50%的機率會發生脫髓鞘疾病,20年內的機率甚至高達八成[122]。約有三成男性且較年輕發病的患者會在54歲時會失去獨立行走的能力[123]。
流行病學

0-0
1-1
2-2
3–5
6–12
13–25
多發性硬化症是最常見的中樞神經自體免疫疾病[15]。2017年,全球約有160至195萬名患者(約每10萬人30名)[16][2],估計每年造成18,000人死亡[124]。個別區域來看,非洲地區的盛行率每10萬人不到0.5人,東南亞每10萬人2.8人,美國每10萬人8.3人,歐洲每10萬人80人[16],部分北歐族裔更超過每10萬人200人[2]。全球每年的發生率(新發生個案)則約為每10萬人2.5人[16]。
多發性硬化症的發生率似乎正在上升,但這或許可以用診斷技術的進步來解釋[2]。近年來,族群研究和地理分布研究越來越普遍[41],科學家也據此相繼提出了一些解釋此現象的理論[12][28][32]。
多發性硬化症常在成年發生,特別是25到35歲,但在少數的情形下也可發生在孩童或大於50歲的人身上[16][2],其中50幾歲的人較常見原發進行性多發性硬化症[65]。就如同許多其他的自體免疫疾病,多發性硬化症在女性較常見,這樣的趨勢正在增加中[5][29]。到2008年為止,女性的發生率約為男性的2倍[16];在兒童中,女性的發生率則比男性高出更多[5];但在超過50歲的人口中,男女的發生率則差不多[65]。
歷史

英國病理學家羅伯特·凱斯威爾教授(1793–1857)和法國解剖病理學家讓·克呂維耶教授(1791–1873)曾描述許多與多發性硬化症症狀類似的疾病細節,但當時他們都尚未把他劃分為獨立診斷[125]。凱斯威爾當時以描述這種疾病為「合併萎縮的脊髓病灶」[5]。1863年,瑞士病理學家喬治·愛德華·林德弗雷奇(1836–1908)在顯微鏡檢下發現沿血管發生的發炎性神經病灶[126][127]。
1868年,法國神經學家讓-馬丁·沙可(1825–1893)在回顧過去文獻,加上自己的臨床和病理觀察後,首次建立多發性硬化症此一診斷[125]。
在沙可建立診斷的同時,他也嘗試首度建立多發性硬化症的診斷標準,並提出著名的「沙可三重症」(Charcot's triad)[註 1]。所謂沙可三重症包含眼球震顫、意向性顫抖、電報式語言等等[128]。沙可另外還觀察到患者有認知功能改變的問題,他描述病人在記憶功能上有明顯減退,且在概念形成上也比較緩慢[18][19]。
自此,沙可三重症成為多發性硬化症的標準診斷依據,直到1965年舒馬克首度提出標準化的診斷標準才逐漸式微。舒馬克導入了散在性病灶、發病時間差,以及「症狀無法以其他解釋」等標準[128]。上述幾項新增的內容都為後來的波色診斷標準及現今廣泛使用的麥克唐納診斷標準所收錄。
到了20世紀,關於此病症病理機轉的理論開始有些進展,到了1990年代之後更發展出了數項治療[5]。2010年重新修訂後的麥氏診斷標準容許利用單一病灶進行多發性硬化症的診斷(即臨床單一症後群)[129]。2013年更將臨床單一症後群列為多發性硬化症的一種表型。自此,不再有「從臨床單一症後群進展為多發性硬化症」的說法存在[130]。

在沙可建立此診斷之前,相關診斷無法進行。下列病例在重新回顧分析後,可能也是多發性硬化症的患者。
11世紀左右,有一名居住於冰島的年輕女性哈朵拉(Halldora)突然失去視力和運動功能,在祈禱之後的七天奇蹟似地恢復。斯希丹的聖李維娜(1380–1433)是一名荷蘭修女,她可能是目前已知最古老的可診斷病例之一。聖李維娜從16歲到她53歲病逝之間的歲月裡,身受間歇性疼痛、下肢無力、視力喪失等症狀所苦,而上述症狀都是典型多發性硬化症的症狀[131]。上述的這兩個病例,也使後人提出多發性硬化症可能源自維京人的假說[132]。
英國國王喬治三世的孫子,奧古斯特·弗德里克·德斯特(1794–1848),是薩塞克斯公爵奧古斯都·腓特烈和茉蕊夫人之子。德斯特在28歲參加完朋友葬禮之後,出現了短暫性視覺喪失的現象。之後他又發生了下肢無力,雙手麻木及動作不協調,膀胱失調,以及陰莖不舉等等,到了1844年他開始使用輪椅輔助他的行動。儘管疾病纏身,德斯特仍然維持樂觀的態度面對人生。他從1822年到1846年的日記至今仍留存於世,紀載了他22年於疾病共生的生活。詳實的病程紀載,使他幾乎可以直接確診為多發性硬化症[133][134]。
英國日記作家布魯斯·弗雷德里克·卡明斯(Bruce Frederick Cummings,1889–1919)以筆名「W·N·P·巴貝利昂」在他的日記詳實紀載他的病程和他的心路歷程[134]。他的日記後來於1919年以《鬱人日誌》(The Journal of a Disappointed Man)為書名集結出版[135]。
研究

為多發性硬化症找尋更有效、更安全,及更方便的藥物治療仍是目前研究重點。其他研究方向包含神經保護策略以及症狀治療方針等等[20]。
自21世紀以來,有多種口服藥物已經核准上市,用藥也逐漸普及[136]。目前仍有多種口服藥物仍在開發中,如ozanimod、拉喹莫德(laquinimod)、雌三醇。拉喹莫德於2012年8月宣布進行治療多發性硬化症的臨床試驗,目前已在進行第三期試驗,但其二期試驗並未顯示顯著效果[137]。除了新藥的開發之外,現有藥物的改良也持續進行中。例如將干擾素β-1a進行聚乙二醇高分子修飾(PEGylated),以期用更少劑量達到相同效果[138][139]。雌三醇是人體自然存在的性激素,後被發現可能可以治療復發緩解型多發性硬化症,目前已進入第二期試驗[140][141]。
單株抗體的高度選擇性使其成為研究重點之一。截至2012年,已有多種單抗顯示可能有潛力對抗多發性硬化症,如阿侖單抗(alemtuzumab)、達利珠單抗(daclizumab),以及利妥昔單抗(rituximab)、奥美珠单抗、奧法木單抗(ofatumumab)等抗CD20的單株抗體[101]。美国食品药品监督管理局(FDA)已於2017年3月核准奥美珠单抗用於復發緩解型的治療[80]。但由於單抗具有免疫抑制的效果,所以有伺機性感染的風險[136]。JC病毒一種一旦感染即會潛伏於體內的病毒,在潛伏期內因為有免疫系統壓制因此不會出現症狀,但那他珠單抗(natalizumab)的使用可能會使病毒打破潛伏,導致進行性多灶性白質腦病(PML)[136]。因此後來建議在用藥前偵測血液中抗JC病毒抗體的多寡,來評估用藥的安全性[136]。從上例可以看出,隨著單株抗體在治療多發性硬化症的重要性逐漸上升,發展相關的監測機制也能提升用藥者的安全[136]。
聯合療法是指同時使用多種藥物進行治療的策略,其發展與創新也是目前的研究焦點之一。若加入另一種藥物能夠提升治療效果的總和,則這樣的作用稱為協同作用。目前已有多種臨床試驗測試聯合療法的效果,但目前為止仍尚未發展出足夠有效的聯合療法[142]。
疾病初期的神經保護及神經再生的研究也是目前的研究重點之一,如幹細胞療法等等[143]。但目前為止尚未有任何療法能夠有效對抗進行性多發性硬化症。目前有多項藥物正在開發中[136]。
多發性硬化症目前尚屬於一種類似症狀集合而成的表現。有些譜系的患者擁有特殊的自體抗體,日後可能透過對於這些自體抗體的研究,將疾病進行更精確的分類。
視神經脊髓炎曾被視為是多發性硬化症的一個分型,後來發現此類患者身上擁有抗AQP4自體抗體。自此與抗AQP4自體抗體相關的疾病光譜,被獨立成為泛視神經脊髓炎譜系(NMO spectrum diseases)[144]。
後來又發現擁有抗MOG自體抗體的患者,在表現上與馬爾堡多發性硬化症類似,也可能以急性瀰漫性腦脊髓炎表現,因此日後此類疾病可能會形成另一種疾病光譜[144]。
抗神經束蛋白自體抗體則是第三種被發現與多發性硬化症相關的自體抗體,此類患者的蘭氏節會遭到破壞,此類疾病主要以周邊神經脫髓鞘疾病表現,但可能出現於慢性原發進行性多發性硬化症或合併中樞神經推髓鞘症狀[145]。
除了上述幾種自體抗體之外,另有四種脫髓鞘疾病於多發性硬化者患者中發現,代表此疾病現在仍為一個異質性相當高的診斷,有待更精確的分類和分型[146]。

雖然可以預期近期內多發性硬化症的診斷標準不會改變,但科學家仍持續在尋找能幫助診斷和預測疾病活性的生物標記分子[136],正在研發中的診斷方法包括抗髓鞘抗體、血清和腦脊髓液分析等,但目前都還沒有顯著的進展[148]。
目前沒有任何檢驗能預測多發性硬化症的預後,一些有潛力的分子包括白介素-6、一氧化氮與一氧化氮合成酶、骨橋蛋白和胎球蛋白-A。由於疾病的預後取決於神經元退化的結果,一些神經組織退化時會出現的蛋白質也正被研究,例如神經絲、tau蛋白和N-乙醯天門冬胺酸。此外,研究者也正在尋找能預測患者是否會對藥物有反應的生物標記分子[148]。
正子斷層造影(PET)和核磁共振成像(MRI)等神經影像技術的進步帶來了更好的診斷力和預後預測能力,雖然這些進步要實際應用到臨床上往往需要數十年的時間[136]。在MRI的部分,數種研究中的技術已證實具實用價值,可逐步導入臨床實務,例如雙反轉回覆序列(DIR)、磁矩轉移、擴散磁振造影(DWI)和功能性核磁共振成像(fMRI)。這些技術相較於現有的技術有更高的專一性,但仍缺乏標準化的檢驗流程和常模數值。還有一些仍在開發中的技術,例如能量測周邊巨噬細胞、發炎或神經失能的程度的顯影劑,以及能測量鐵沈積量或大腦灌流量的技術[149]。同樣地,新的PET放射性追蹤劑能觀測特定生物反應的變化,例如腦組織發炎、皮質病灶、細胞凋亡或再髓鞘化(remylienation)[150]。抗Kir4.1鉀離子通道抗體也可能和多發性硬化症有關[151]。
大眾文化
- 《黃金庭院》
註釋
參見
參考文獻
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.