原子
From Wikipedia, the free encyclopedia
Remove ads
原子(粵拼:jyun4 zi2)係粒子。係保持佢化學特性可以存在嘅最細粒子。

原子由質子、中子同電子三種次原子粒子組成。原子係基本嘅化學概念;化學作用入面原子嘅數量毋會變,係研究化學作用嗰陣嘅基本假設。
名稱
原子嘅英文名由希臘話轉化過嚟,原本意思係「毋可以再切分」。早響公元前,古希臘哲學家就講過原子嘅概念。大約喺公元前450年,德謨克利特就創造咗「原子」爾隻詞,意思就係「毋切割得」。
到咗17至18世紀,英國化學家道爾吞(John Dalton)提出過:某啲物質毋可能用化學手段繼續分解。當時重未有質子、中子等嘅概念。一直到19世紀尾,物理學家開始發現原子嘅內部結構,由此證明原子並毋係毋可以繼續切分。
結構
次原子粒子
内文:次原子粒子
「原子」(atom)呢個詞原本係指細到唔可以再切開嘅粒子,不過而家科學上講嘅原子係由唔同嘅次原子粒子組成嘅物質最基本嘅單位。原子係由電子、質子同中子組成嘅。
電子帶負電,質量係 9.11×10−31 kg,係呢啲粒子入面最輕嘅,所以現有嘅科技都冇辦法測到佢嘅大細[1]。在發現中微子有質量之前,電子係已知最輕嘅有靜止質量嘅粒子。喺正常情況下,電子由於佢哋嘅負電荷而被吸引喺帶正電嘅原子核周圍。如果原子嘅電子數多過或少過佢嘅原子序數,呢個原子就會變成帶電嘅離子。電子喺19世紀尾已經被發現,當中約瑟夫·約翰·湯姆森嘅貢獻好大(睇吓Template:Ill2)。
質子帶正電,質量係1.6726×10−27 kg,係電子質量嘅1,836倍。原子入面質子嘅數量就係原子序數。厄尼斯特·盧瑟福喺1917-1919年觀察到alpha粒子撞到氮原子之後會射出好似係氫原子核嘅嘢。到1920年,佢認為呢啲氫原子核係原子入面嘅獨立粒子,並將佢命名為質子。
中子冇電荷,自由質量係 1.6749×10−27 kg,係電子質量嘅1,839倍[2][3]。中子係三種粒子入面最重嘅,不過佢嘅質量可能會因為Template:Ill2而減少。中子同質子(統稱為核子)嘅大細都係差唔多 2.5×10−15 m,不過呢啲粒子嘅「表面」冇一個明確嘅定義[4]。中子係1932年由英國物理學家詹姆斯·查德威克發現嘅。
喺物理學嘅標準模型入面,電子係冇內部結構嘅真正基本粒子,而質子同中子係由叫做夸克嘅基本粒子組成嘅複合粒子。原子入面有兩種夸克,佢哋都帶有分數電荷。質子係由兩個上夸克(每個帶+23電荷)同一個下夸克(帶-13電荷)組成。中子就係由一個上夸克同兩個下夸克組成。呢個分別可以解釋點解兩種粒子嘅質量同電荷會唔同[5][6]。
夸克透過強相互作用(強力嘅另一個稱呼)同膠子結合埋一齊。質子同中子喺原子核入面透過核力互相結合。核力係強力嘅殘留作用,佢嘅範圍同特性同強力有啲唔同(睇吓核力(英文版))。膠子係一種規範玻色子,即係傳遞物理力嘅基本粒子[5][6]。
原子核
内文:原子核

喺原子入面,所有質子同中子都結合埋一齊形成一個細細嘅原子核。原子核嘅半徑大約係 飛米 (fm),呢度嘅 係核子總數[7]。原子核嘅半徑細過原子半徑好多,原子半徑係105 fm 數量級 嘅。核子之間透過叫做強殘留力嘅短程引力勢能結合埋一齊。喺2.5 fm 以內嘅距離,呢種力遠大過正電嘅質子之間嘅靜電力排斥力[8]。
同一元素嘅原子,佢哋嘅原子序數即係質子數係一樣嘅。同一元素嘅原子可以有唔同數目嘅中子,呢啲就係呢個元素嘅同位素。質子同中子嘅總數決定咗核種。質子同中子嘅比例決定咗原子核嘅穩定性,有啲同位素會發生放射性衰變[9]。
質子、中子同埋電子都係費米子(Template:Lang-en-short)。費米子要遵守泡利不相容原理,即係話同一種費米子唔可以同時處於同一量子狀態。所以,原子核入面嘅每一個質子都要有唔同嘅量子狀態,中子同埋電子雲入面嘅電子都係一樣[10]。
如果一個原子核入面嘅質子同中子數目唔平衡,佢可能會通過放射性衰變,令到質子同中子嘅數目變得更加接近,從而達到更低嘅能量狀態。所以,質子同中子數目相同嘅原子通常會更加穩定。不過,隨住原子序數增加,為咗抵消質子之間嘅排斥力,穩定嘅原子會需要更多嘅中子[10]。
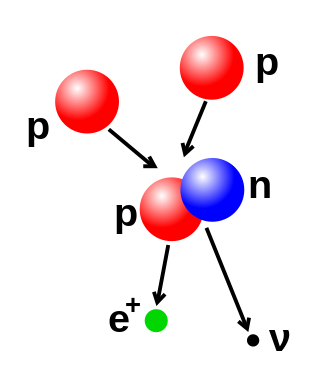
要改變原子核入面嘅質子同中子數目係需要好大嘅能量,因為佢哋之間有強核力。核融合係指兩個原子核相撞,然後合併成一個更重嘅原子核嘅過程。例如喺太陽嘅中心,質子要克服互相之間嘅排斥力(庫侖障礙)先至可以融合,呢個過程需要 3-10 keV 嘅能量[11]。核裂變就係相反嘅過程,通常係原子核通過放射性衰變分裂成兩個較小嘅原子核。原子核都可以通過同高能亞原子粒子或者光子相撞而改變。如果呢啲過程改變咗質子嘅數目,就會令到原子變成另一種化學元素[12][13]。
如果核融合之後嘅原子核質量細過融合前嘅粒子質量之和,呢個質量差就會根據愛因斯坦嘅質能等價公式 e=mc2(m 係質量損失,c 係光速)轉化成能量釋放出嚟,可能以伽馬射線或者β粒子嘅動能形式出現。呢個質量損失係新原子核嘅結合能嘅一部分,融合後嘅粒子會因為呢個能量嘅不可逆損失而維持喺一齊[14]。
兩個原子序數細過鐵或者鎳嘅原子核(總核子數少過大約60)嘅融合通常係一個放熱反應,釋放嘅能量會多過融合所需嘅能量[15]。呢個能量釋放嘅過程就係令到恆星嘅核融合可以持續進行嘅原因。對於更重嘅原子核嚟講,每個核子嘅結合能會開始減少(睇上面嗰個圖)。咁就意味住,原子序數大過大約26同埋質量數大過大約60嘅原子核嘅融合過程係一個吸熱反應。所以,更重嘅原子核就冇辦法通過核融合反應產生足夠嘅能量嚟維持恆星嘅靜水壓平衡[10]。
電子雲
睇埋:電負性

原子入面嘅電子受到電磁力嘅吸引,呢種力係嚟自原子核入面嘅質子。呢種力令到電子被困喺圍繞住細細粒原子核嘅靜電Template:Ill2入面,要令電子逃脫就需要外部能量。電子越接近原子核,呢種吸引力就越大。所以,喺勢阱中心附近嘅電子要逃脫需要比較遠處嘅電子更多嘅能量。
電子同其他粒子一樣,都有粒子同波嘅特性。電子雲就係喺勢阱入面,每個電子形成一種三維駐波(相對於原子核冇移動嘅波形)嘅區域。呢種行為由原子軌道決定。原子軌道係一個數學函數,佢描述當你測量電子位置嘅時候,發現電子喺某個特定位置嘅機率[16]。喺原子核周圍只有一啲離散嘅(或者叫量子化嘅)軌道集合(其他可能嘅波動模式會好快衰減到更穩定嘅形態)[17]。軌道可以有一個或者多個環狀或者節點結構,每個軌道嘅大細、形狀同方向都可能唔同[18]。

每個原子軌道都對應住電子嘅一個特定能級。電子可以通過吸收一個有足夠能量嘅光子嚟提升佢嘅能級。同樣,高能級嘅電子可以通過自發輻射嘅方式釋放多餘嘅能量,以光子嘅形式放出嚟,然後跌返低能級。呢啲量子狀態之間嘅能量差就係原子光譜線Template:Enlink產生嘅原因[17]。
要從原子度除去或者加入電子所需要嘅能量(電子結合能Template:Enlink)係遠細過核子嘅結合能。例如,要將氫原子嘅基態電子移走只需要 13.6 eV 嘅能量[19],但係要分裂氘嘅原子核就需要 223萬eV 嘅能量[20]。如果質子同電子嘅數目一樣,原子就係電中性嘅。缺少或者多咗電子嘅原子就叫做離子。離原子核最遠嘅電子可能會移動到附近嘅另一個原子度,或者喺原子之間共享。呢個機制令到原子可以鍵合形成分子,或者同其他類型嘅化合物鍵合形成離子晶體或者網狀共價鍵晶體[21]。
Remove ads
識別

原子細到肉眼睇唔到,但係可以用掃描隧道顯微鏡(STM)噉嘅儀器將固體表面嘅原子可視化。呢部顯微鏡利用量子隧穿效應,令粒子可以穿過喺經典物理學角度嚟講係過唔到嘅勢壘。電子會穿過兩個偏壓電極之間嘅真空,產生一個隨距離指數衰減嘅隧穿電流。其中一個電極係一條尖尖嘅探針,理想情況下以單一原子做頂。喺掃描表面嘅每一點,探針嘅高度會調整到保持隧穿電流喺設定值。探針同表面有幾近或者幾遠就會解釋成高度剖面。喺低偏壓嘅情況下,顯微鏡會影到平均咗嘅橫跨密集能級嘅電子軌道,即係費米能級附近電子嘅局部態密度[22][23]。因為距離好重要,要觀察到同單個原子對應嘅週期性,兩個電極都要極之穩定。單憑呢個方法冇化學特異性,唔能夠識別表面存在嘅原子種類。
可以好容易用質量嚟識別原子。將一個電子從原子度拎走電離之後,佢穿過磁場嘅時候軌道就會彎曲。移動嘅離子喺磁場入面軌道彎曲嘅半徑由原子嘅質量決定。質譜法就係用呢個原理嚟量度離子嘅質荷比。如果樣本有多個同位素,質譜儀可以量度唔同離子束嘅強度,從而決定樣本入面每種同位素嘅比例。原子汽化方法包括電感耦合等離子體發射光譜法同電感耦合等離子體質譜法,兩種方法都係用等離子體嚟汽化樣本再分析[24]。
Template:Ill2可以喺三維空間入面做到亞納米級嘅分辨率,仲可以用飛行時間質譜法嚟化學鑑定單個原子[25]。
量度內層電子結合能嘅電子發射技術,好似X射線光電子能譜(XPS)同俄歇電子能譜(AES),可以用嚟無損咁識別樣本入面存在嘅原子種類。如果聚焦得啱,兩種方法都可以分析特定區域。另一個方法係電子能量損失能譜(EELS),佢係量度透射電子顯微鏡(TEM)入面電子束同樣本一部分相互作用時嘅能量損失。
激發態嘅光譜都用嚟分析遠處恆星嘅原子組成。可以將觀察到嘅恆星光入面特定波長嘅光分離出嚟,再同自由氣體原子嘅量子化躍遷對應。呢啲顏色可以用含有相同元素嘅Template:Ill2重現出嚟[26]。就係噉,氦喺太陽光譜度發現咗,比喺地球上發現早咗23年[27]。
睇埋
參考
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads

![{\displaystyle 1.07{\sqrt[{3}]{A}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/a74a6ca6998768195969eef75ca046e8431c29d3)
