热门问题
时间线
聊天
视角
CPK配色
来自维基百科,自由的百科全书
Remove ads
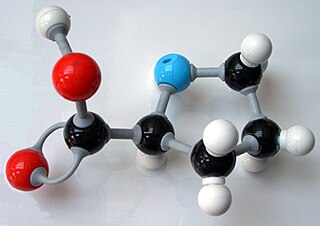
在化學中,CPK配色是一種國際通用的原子或分子模型的配色方式,也是最常用、最多人使用的分子模型上色方式,可用於各種分子模型或元素標示,最常用於球棒模型和空間填充模型。該配色方式由CPK模型的設計者Corey、Pauling(萊納斯·鮑林)與Koltun提出且改進。

歷史
1952年,科裡和鮑林發表了描述蛋白質和其他生物分子的空間填充模型,他們已經在加州理工學院製做出一個模型[1]。他們用硬木球表示原子並塗上一些代表性的鮮豔顏色,來表示相應的化學元素。他們的上色模式為:
他們還建立塑膠球小模型使用搭配同色系的架構。
1965年,Koltun將Corey和鮑林建模技術的改進版本申請專利獲准[2]。在他的專利中,他提到了以下顏色:
現在常用的CPK配色將色彩更變為:
Remove ads
典型的配色

典型的CPK配色包括:
| 氫 (H) | 白色 | |
| 碳 (C) | 黑色 | |
| 氮 (N) | 深藍色 | |
| 氧 (O) | 紅色 | |
| 氟 (F)、 氯 (Cl) | 草綠色 | |
| 溴 (Br) | 紅棕色 | |
| 碘 (I) | 深紫羅蘭色 | |
| 惰性氣體 (He、 Ne、 Ar、 Kr、 Xe) | 水藍色 | |
| 磷 (P) | 橘色 | |
| 硫 (S) | 黃色 | |
| 硼 (B)、大多數過渡金屬 | 桃色、 鮭魚的顏色 | |
| 鹼金屬 (Li、Na、K、Rb、Cs、Fr) | 紫色 | |
| 鹼土金屬 (Be、Mg、Ca、Sr、Ba、Ra) | 深綠色 | |
| 鈦 (Ti) | 灰色 | |
| 鐵 (Fe) | 鐵鏽色 | |
| 其他元素 | 洋紅色 |
有些CPK顏色是來自於純元素的顏色或該元素的常見化合物的顏色,以便於記憶。例如,氫是一種無色氣體;碳、木炭或石墨皆是黑色;常見的硫是黃色的;氯氣是一種綠色氣體;溴溶於乙醚是一個暗紅色的液體;碘是紫羅蘭色的;無定形磷是紅色;鐵鏽是暗橙色紅色等。對於一些的顏色,如氧氣和氮氣,則來源不可考。也許是因為氧氣燃燒或含氧血液中血紅蛋白呈紅色所以將氧定義成紅色;氮是地球的大氣層的主要組成部分,從而出現到人眼看到的天空為天藍色因此將氮設定成藍色。[來源請求]
Remove ads
化學鍵的顏色
一般化學鍵的顏色會依據鄰近元素上色,若兩端元素相同,則將鍵漆上鄰近原子的顏色,若兩端原子不同,則依照電子雲可能的分佈來決定兩端元素在鍵上上色的比例。有些模型則將鍵統一塗上同一種顏色,常見的顏色為灰色或白色。離子鍵一般不會描繪,另外氫鍵也有人使用黃色的虛線表示[3]
其他的CPK配色方式
下表顯示了一些流行的軟體分配給每個元素的顏色。C列是原始由Corey和鮑林設定的CPK配色[1],K是Koltun的專利[2],J列是由分子可視化的Jmol使用的配色方案[4],R列是Rasmol使用的配色方案,其顯示兩種顏色,第二種表是2.7.3及以後版本所使用的顏色[4][5]。所有的顏色都很相似的,並且可能依賴於顯示硬體和觀看條件。
Remove ads
參見
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
