热门问题
时间线
聊天
视角
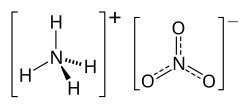
硝酸銨
化合物 来自维基百科,自由的百科全书
Remove ads
硝酸銨是一種化合物,是銨離子的硝酸鹽。它的化學式是(簡化為),是一種白色的固體結晶,在水中溶解度高。它在農業上主要作為高氮肥料使用。[2]也是採礦、採石和土木建築中使用的爆炸混合物的成分之一。它也是銨油炸藥的主要成分,這是一種普遍的工業炸藥,佔北美炸藥使用量的80%。類似的配方也用於簡易爆炸裝置(IED,俗稱土製炸彈)。由於擔心有被誤用的可能性,許多國家正把它從消費性應用中階段性淘汰。[來源請求]
此條目需要補充更多來源。 (2020年8月6日) |
Remove ads
性質
硝酸銨遇熱能夠分解。
- 169 °C:
- 230 °C,反應迅速進行:
- 300 °C:
- 400 °C以上,反應極為猛烈:
Remove ads
反應生成
硝酸銨在智利最乾旱的地區阿塔卡馬沙漠被發現為天然礦物(硝石礦物例如硝酸鈉),它通常是在地表層和/或與其他硝酸鹽,氯酸鹽,碘酸鹽和鹵化物礦物質結合一起。過去硝酸銨在那裡開採,但現在使用的化學物質幾乎都是是合成的。
生產
硝酸銨的工業化生產涉及氨與硝酸的酸鹼反應:
合成方法:
氨以無水形式(即氣體形式)使用,硝酸則是高濃度的。這種反應是劇烈的,由於其高放熱性的物質本性。通常溶液形成後的濃度約為83%,剩餘的水會依據等級不同,被蒸發成濃度95%至99.9%的硝酸銨(AN熔體)。然後將95%至99.9%的AN熔體在噴霧塔中製成「顆粒」或小珠,或者通過在旋轉的滾筒中噴霧和翻滾而製成稍大顆粒。小顆粒或大顆粒都可以進一步乾燥,冷卻,然後包膜以防止結塊。這些小或大顆粒是典型的AN商業產品。
該方法所需的氨可通過哈伯法(Haber process)從氮和氫獲得。由哈伯法生產的氨再通過奧士華法(Ostwald process)可氧化成硝酸。另一種生產方法是變形的硝磷銨法(Odda process):
產物碳酸鈣和硝酸銨可以純化分離或者以鈣化硝酸銨的形式出售。硝酸銨也可以通過複分解反應得到:
Remove ads
硝酸銨可與金屬氫氧化物反應,釋放氨並形成金屬硝酸鹽:
- (M = Na,K等)
硝酸銨加熱時不會有殘留物:
Remove ads
由於條件變化(例如溫度,壓力)導致的晶體狀態的變化影響硝酸銨的物理性質。 下述結晶狀態已被確認:[3]
| 晶系 | 溫度 (°C) | 狀態 | 體積變化 (%) |
| > 169.6 | 液體 | ||
| I | 169.6 to 125.2 | 立方(等軸)晶系 | -2.1 |
| II | 125.2 to 84.2 | 四方(正方)晶系 | +1.3 |
| III | 84.2 to 32.3 | α-斜方晶系 | -3.6 |
| IV | 32.3 to −16.8 | β-斜方晶系 | +2.9 |
| V | −16.8 | 四方(正方)晶系 |
第五(V)型晶體是與氯化銫相關的類立方形式,硝酸根陰離子的氮原子和銨陽離子的氮原子在晶格中的位置對應CsCl晶格中的Cs和Cl。
應用
硝酸銨是一種重要的肥料,NPK等級為34-0-0(34%氮)。 它的濃度低於尿素(46-0-0)[4],使硝酸銨在運輸方面稍有劣勢。硝酸銨比尿素的優勢在於它更穩定,不會迅速向大氣中損失氮。不過,硝酸銨是一種危險的物質,因為它具有高度爆炸性。因此,其製造和儲存的規定非常嚴格,尤其是在歐盟。[5]根據法規,這些產品需要被檢查與測試,並且技術文檔必須證明產品的安全性。[6] 如果不加重視,則可能引發嚴重的安全事故,例如在貝魯特發生的事故。
硝酸銨本身不是一種爆炸物,[7] 但當與主要爆炸物如疊氮化物或燃料如鋁粉或燃料油組合時,它很容易形成具有不同性能的爆炸性混合物。
硝酸銨在敏感度方面而言是極其鈍感的炸藥,比安全炸藥C4炸藥更為鈍感。一支工業8#雷管(起爆C4炸藥只需要6#)都不足以起爆混合了敏化劑的硝酸銨。硝酸銨是最難引爆的硝酸炸藥,撞擊感度是:50kg鎚50cm落高,0%爆炸。相比起著名炸藥硝化甘油的200g鎚,20cm落高,100%爆炸的感度,可見硝酸銨的鈍感。而且硝酸銨一旦溶於水,起爆感度更是大大下降,人類根本不可能把它撞擊引爆。
硝酸銨對高溫的耐受力較差,分解溫度一般大於或等於180度,但一般不會爆炸性分解。但當硝酸銨暴露於過高溫度時便會有發生爆炸性分解的風險。
肥料炸彈(ANFO)是94%硝酸銨(「AN」)和6%燃油(「FO」)的混合物,被廣泛用作散裝工業炸藥。[8]:1ANFO低成本和易於使用的優點用於採煤、採石、金屬開採等初階應用,不論在耐水性、氧氣平衡、高爆震速度和小直徑性能等都比傳統工業炸藥更好。[8]
因為硝酸銨在水中的溶解是高度吸熱的,因此其使用於某些即溶冰敷袋上。它也被用於獨立爆炸的「燃料」,如硝酸胍,[9][10]日本的安全氣囊大廠高田公司製造的安全氣囊的氣體中使用硝酸銨作為5-氨基四唑的低成本(但不太穩定)替代品。因沒有加入乾燥劑,使得硝酸銨會因為久了之後受潮及高溫而變質,當氣囊作動時會因力道過大而使零件碎片飛散,反而造成車上駕駛及乘客因此受傷甚至死亡,並在造成14人死亡後因不安全被召回。[11]受影響的汽車品牌甚廣,全球召回的車輛達上千萬輛。[12]
根據Knoema網站的數據,2017年前5大出口國分別為俄羅斯、立陶宛、喬治亞、保加利亞和美國。但中國的出口數據未列入其中。[13]
安全、管理和儲存
健康和安全數據記載在供應商提供的安全資料表上,在網際網路上可以找到。[14]為了因應數起導致許多人死亡的爆炸,美國環境保護署(EPA),職業安全與健康管理局(OSHA)以及美國菸酒槍炮及爆裂物管理局(ATF) 聯合頒布了安全準則。[15]
加熱或任何點火源可能會引起劇烈的燃燒或爆炸。[16]硝酸銨可與可燃和還原材料反應,因為它是一種強氧化劑。雖然主要是用於肥料,但亦可用於爆炸物。有時候用來開鑿土地做農場池塘。[17][18]硝酸銨也用於改變其他爆炸物的爆炸速度,例如把三硝基甲苯(TNT)轉變成阿馬托炸藥(一種無煙炸藥)。
硝酸銨的儲存和處理有許多可行的安全準則。[19]硝酸銨不應該存放在易燃物質附近。硝酸銨與某些物質如氯酸鹽,無機酸和金屬硫化物不相容,接觸會導致劇烈或甚至猛烈的分解。[20]
硝酸銨的臨界相對濕度為59.4%,高於此值將吸收大氣中的水分。因此,將硝酸銨儲存在密封容器中是很重要的。否則它會吸濕結成塊。硝酸銨可以吸收足夠的水分液化。將硝酸銨與某些其他肥料混合可以降低臨界相對濕度。[21]
這種材料有被作為爆炸物的潛在性,促使了監管措施。例如,在澳大利亞,「危險品條例」於2005年8月生效,以執行處理此類物質的許可。[22]許可證僅授予申請者(工業),並採取適當的安全措施,以防止任何濫用。[23]其他用途,如教育和研究目的可以考慮使用,但個人使用則不允許。有執照處理該物質的人員仍須經授權人員監督,並在執照獲得許可前應該要通過安全和國家警察檢查。
健康危害
根據健康和安全數據顯示,在安全資料表中,硝酸銨可從供應商處獲得,並可在網際網路上找到。[24]
硝酸銨對健康並不十分有害,通常用於化肥產品。[24][25][26]
硝酸銨的半數致死劑量(LD50)為2217毫克/公斤(有毒物質的質量和試驗生物體重比),[27]其比較約為食用鹽的三分之二。
災害
硝酸銨在加熱時分解成一氧化二氮和水蒸氣(不是爆炸性反應)。然而,它可以被爆炸引起熱風分解。由於硝酸銨本身可提供燃燒所需氧氣,所以大量儲存的硝酸銨會有很高的火災風險,而且也可能被引爆。
導致爆炸的兩大主要類型是:
- 由於引爆機制的轉變而產生爆炸。先是從一堆爆炸物中的炸藥包起爆,接著由爆炸外殼射進易爆物引爆,或由爆炸混合物與一堆易爆物接觸引爆。例子是Kriewald,Morgan(今日Sayreville,新澤西州),Oppau和Tessenderlo。
- 爆炸是由火災蔓延到硝酸銨本身(德克薩斯城,布雷斯特,奧克代爾PA),或由火災中的硝酸銨與可燃物的混合物(Repauno,切諾基,Nadadores)造成。火災至少需要在一定的溫度上,完成從燃燒到爆炸的轉換(一種稱為「爆燃到爆轟轉變」的現象)。純的、緊湊的硝酸銨(AN)是穩定的,很難點燃,並且許多情況下,甚至不穩定的AN都沒有在火中爆炸。
- 德克薩斯城災難:1947年4月16日清晨,一艘停泊於美國德克薩斯城的貨輪Grand Camp號起火,引爆了船上的2300噸硝酸銨。爆炸還產生了連鎖反應,導致附近的化工廠爆炸。沖天的大火直衝雲霄,全城都能看見港口上升起的橙色濃煙。這次爆炸令大約600人死亡,3500多人受傷,被認為是美國歷史上最嚴重的工業爆炸事故。
- 1963年1月9日,芬蘭奧盧(Oulu)一家生產硝酸銨的化工廠發生爆炸,10人死亡。
- 1994年6月23日凌晨,天津市冶金局鋁材廠在加溫硝酸銨過程中,因未嚴格按照安全操作規程操作,致使池內的硝酸銨發生爆炸,與該廠相鄰的大部分建築物被摧毀,造成10人死亡,23人受傷。
- 1994年7月28日中午,四川蓬溪縣某化肥廠由於管理不善,4名兒童混入了該廠硝酸銨庫房背後,利用庫房通風洞給灶爐點火烤魚吃,結果火苗從通風洞引燃了百葉窗,緊接著又引燃了庫房內的硝酸銨。致使147人中毒住院搶救,3人搶救無效死亡。
- 2001年9月21日,法國土魯斯AZF化工廠20-120噸硝酸銨發生爆炸,TNT當量為20-40噸,導致31人死亡,約2500人受傷。
- 朝鮮龍川火車站爆炸事件:發生於2004年4月22日,至少161人死亡,1300多人受傷。
- 天津港危化品倉庫爆炸事故:發生於2015年,造成165人死亡。
- 貝魯特爆炸事故:發生於2020年8月4日,造成至少220人以上死亡。[28]
參考文獻
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads







![{\displaystyle {\ce {5NH4NO3 ->[\Delta]4N2 (^) + 2HNO3 + 9H2O}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/0042134a86cf3cffc37578883039413ecd0f2e55)
![{\displaystyle {\ce {2NH4NO3 ->[\Delta] 4H2O + 2N2 (^) + O2 (^)}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/d679ed931d0b3b9ee4ad3a41886977e474937410)






