热门问题
时间线
聊天
视角
鐵硫蛋白
来自维基百科,自由的百科全书
Remove ads
鐵硫蛋白(英語:Iron-sulfur protein,或稱為鐵硫蛋白質)是一類蛋白質,其特徵是其中存在著鐵-硫簇,鐵-硫簇中含有與硫連接著的二、三或四個鐵中心,並可處於各種變化的氧化態上。鐵-硫簇存在於多種金屬蛋白之中,例如鐵氧還蛋白、氫化酶、輔酶Q-細胞色素c氧化酶、琥珀酸脫氫酶,和固氮酶等[1]。鐵硫蛋白是粒線體中執行氧化磷酸化過程的重要成員,像電子傳遞鏈中的第一蛋白複合體(Complex I)及第二蛋白複合體(Complex II)都含有鐵硫簇。此外,像是順烏頭酸酶和SAM依賴蛋白中也有鐵硫簇,另外硫辛酸及生物素的合成也牽涉到鐵硫簇。可見鐵硫簇的作用範圍包括呼吸作用、光合作用、羥化作用以及細菌的氫和氮的固定。
此條目需要擴充。 (2011年9月15日) |
鐵硫蛋白可用基因表現來調控,且容易被一氧化氮破壞。
由於這些蛋白質在大多數生物體的代謝途徑上的普遍性,導致一些科學家理論化鐵-硫化合物在鐵-硫世界理論中的生命起源的探討中扮演重要角色。
Remove ads
結構模體
在幾乎所有的鐵硫蛋白中,Fe中心都是四面體,末端配體是半胱氨酸殘基的硫醇基硫中心。 硫化物基團是兩個或三個配位的。 具有這些特徵的三種不同類型的Fe–S簇最為常見。

最簡單的多金屬系統[Fe2S2]簇由兩個鐵離子組成,兩個鐵離子橋接兩個硫離子,並由四個半胱氨酸配體(在Fe2S2鐵氧還蛋白中)或兩個半胱氨酸和兩個組氨酸(在里斯克蛋白質中)配位。 被氧化的蛋白質包含兩個Fe3+離子,而被還原的蛋白質包含一個Fe3+和一個Fe2+離子。 這些物質以兩種氧化態(FeIII)2和FeIIIFeII存在。 CDGSH鐵硫結構域也與2Fe-2S簇相關。
一個常見的模體具有四個鐵離子和四個硫化物離子,它們位於立方體式簇的各個頂點上。 Fe中心通常由半胱氨醯基配體進一步配位。 [Fe4S4]電子轉移蛋白([Fe4S4]鐵氧還蛋白)可以進一步細分為低電位(細菌型)和高電位(HiPIP)鐵氧還蛋白。低電位和高電位鐵氧還蛋白與以下氧化還原方案相關:

還已知蛋白質包含[Fe3S4]中心,其特徵是比更常見的[Fe4S4]核心少一個鐵。 三個硫化物離子分別橋接兩個鐵離子,而第四個硫化物橋接三個鐵離子。
更複雜的多金屬系統是常見的。 例子包括固氮酶中的8Fe和7Fe簇。 一氧化碳脫氫酶和[FeFe]-氫化酶還具有不尋常的Fe–S簇。 在耐氧膜結合的[NiFe]氫化酶中發現了一個特殊的6個半胱氨酸配位的[Fe4S3]簇[2][3]。
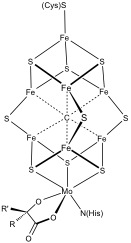
生物合成
Fe-S簇的生物合成已經被很好的研究[4][5][6]。鐵硫簇的生物發生已在大腸桿菌,葡萄麴黴和釀酒酵母這三種細菌中得到了最廣泛的研究。 迄今為止,至少鑑定了三種不同的生物合成系統,即nif,suf和isc系統,它們首先在細菌中鑑定出來。 nif系統負責硝化酶中的簇。 suf和isc系統更為通用。
參閱
參考文獻
深入閱讀
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads