蛙壶菌(学名:Batrachochytrium dendrobatidis)是一种壶菌门真菌,可以引起两栖类的壶菌病。它们最初是于1998年发现[1],在其后的十年内,造成了大量两栖类的死亡,引发多个物种灭绝,是为全新世灭绝事件之一。被国际自然保护联盟物种存续委员会的入侵物种专家小组(ISSG)列入世界百大外来入侵种。两栖类共有12科38种会感染壶菌病,包括蛙科动物和树蟾科青蛙,蟾蜍,蝾螈和无肺螈科[2]。
Quick Facts 蛙壶菌, 科学分类 ...
蛙壶菌
|
|
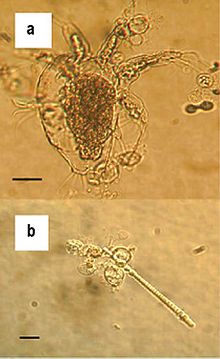
| 在(a)淡水节肢动物及(b)藻类上生长的壶菌游离孢子。
|
科学分类 
|
| 界:
|
真菌界 Fungi
|
| 门:
|
壶菌门 Chytridiomycota
|
| 纲:
|
壶菌纲 Chytridiomycetes
|
| 目:
|
壶菌目 Chytridiales
|
| 科:
|
壶菌科 Chytridiaceae
|
| 属:
|
Batrachochytrium属 Batrachochytrium
|
| 种:
|
蛙壶菌 B. dendrobatidis
|
| 二名法
|
Batrachochytrium dendrobatidis
Longcore, Pessier & D.K. Nichols (1999)
|
Close
一些两栖类物种具有天生的免疫能力。就算一些患上壶菌病的物种,也能够生存下来,显示出演化性选择的痕迹或等位基因。不过另一个解释却指一些蛙壶菌的形态并非真正的病原体。
蛙壶菌是Batrachochytrium属下的唯一物种。最初将它们分类在壶菌门下是基于孢子的超显微结构,DNA分析也证实了这个观点。
蛙壶菌可以在4-25℃的气温下生长,最适于17-25℃。[3]因此,它们可以在寄主的身上过冬。在25℃以上它们的生长较差,若高于28℃,生长就会停止。[3]受感染的红眼雨滨蛙只要留在37℃的环境就可以痊愈。[4]
蛙壶菌感染两栖类的角蛋白皮肤。它们在表皮上的叶状体有假根网络及孢子囊。每个孢子囊都有一条管放出孢子。
蛙壶菌的游离孢子一般大3-5微米,呈长卵形,后端有一条19-20微米长的鞭毛,并藏有核糖体的铰链区。一般会有一层球状的膜包裹核糖体。在细胞体末端有一个细小的距,可能只是标本在甲醛固定时的加工品。核糖体的铰链区由1个内质网的内胞浆网槽、2-3个线粒体及大型的微体所包围。微体之间紧密排列,包围着约4-6个脂质球,有一些脂质球似乎是被内胞浆网槽所包围。一些游离孢子会包含较多的脂质球。并没有发现孢尾体。
在毛基体侧有一个失效的细胞中心粒。9个互扣的支柱将毛基体固定在质膜上,在过渡带上有终板。以横向角度观察过渡带上的鞭毛小管,可以见到内部的环状结构。毛基体并没有根。大部分游离孢子的核会有部分在核糖体群中,故偏向侧面。在核糖体区以外的细胞质中,会有细小的液泡及高尔氏体。包含少量核糖体的线粒体会聚在盘状的崤上。[5]
蛙壶菌有两个主要的生命阶段:无柄及繁殖的游动孢子囊,和活动及有鞭毛的游离孢子。游离孢子只会在短时间内很活跃,能够移动一段短距离。[6]不过,游离孢子具有化学趋向性,会向两栖类表面的分子(如糖、蛋白质及氨基酸)前往。[7]它们也含有多种蛋白水解酶及酯水解酵素,帮助消化两栖类细胞,以两栖类的皮肤作为养份供应来源。[8]当游离孢子到达其寄主时,它们会在皮肤下层形成一个孢囊,进入繁殖阶段,发展为游动孢子囊。游动孢子囊会生产更多的游离孢子,不断感染寄主的皮肤,或释放到周边的水生环境。[9]
蛙壶菌有时会出现与传统游离孢子或孢子囊不同的菌型。例如,在2003年欧洲热浪,莱桑池蛙未被壶菌病大量杀死前,就有一种球状、单细胞及只有80-120微米大的蛙壶菌。于当时并不知道它们是什么,到后来才确定是蛙壶菌。它们也是有包在囊中的游离孢子,可以嵌入在休眠孢子中、腐生的或寄生的,并且在一些条件下非病原性的。[10]当热浪开始时,蛙壶菌变成了现时会引起疾病的游离孢子。由此可见,一些两栖类群落身上虽有蛙壶菌存在,但却没有感染壶菌病,并非因为牠们具有免疫能力,而是其环境并没有足够条件让蛙壶菌变型。
蛙壶菌在两栖类的皮肤上生长,及制造水生的游离孢子。[11]它们广泛分布在沙漠及低地森林至寒冷的山顶。它们可以是不致命的寄生虫,或是腐生植物。它们会令栖于高地的两栖类,或于冬天时造成大量的死亡率,在低温下较易发病。[12]
有指蛙壶菌是源于非洲,后来经非洲爪蟾的贸易而广传世界各地。[13]研究涉及697个爪蟾属标本,都是于1879年至1999年在南部非洲采集。最早出现壶菌病的是于1938年发现的非洲爪蟾。研究亦指在壶菌病在非洲以外的地方传播前,早已在非洲内肆虐了23年的时间。[13]
由于美国牛蛙的低感染率,故也被指是带菌者。[14][15]美国牛蛙经常从圈养中逃走,并能够建立野生群落,可以将蛙壶菌带到其他地方。[6]蛙壶菌可以生湿润的土壤及鸟类羽毛中生存,这也可以其传播途径。[16]壶菌病感染与北美洲、南美洲、中美洲、欧洲及澳洲两栖类的大量死亡有关。[17][18][19]它们也被指导致了澳洲的Taudactylus acutirostris的灭绝。[20]
一些两栖类特别容易感染蛙壶菌,包括林蛙[21]、黄腿山蛙[22]、南方双带河溪螈[23]、杰斐逊钝口螈[24]、三锯拟蝗蛙、蟋蟀雨蛙、霍氏锄足蛙、南方豹蛙[25]、里奥格兰德豹蛙[26]及撒丁山螈。[27]
于2008年,两个蛙壶菌的分离物基因组被DNA定序,科学家已积极将有关资料用在了解蛙壶菌在分子层面的生命周期及两栖类的病原性。在9000个基因的研究中发现,多于55%在孢子囊及游离孢子之间有不同的基因表现。[28]多种金属蛋白酶的表现相信是引发病原性,并会造成皮肤上的感染。[29]
由于蛙壶菌造成两栖类的严重衰落,科学家们都在研究如何抗衡。其中一项研究发现,那些能够在感染壶菌病仍能生存下来的,倾向带有大量的兰黑紫色杆菌。[30]这些细菌会生产抗真菌的化合物,如吲哚-3-甲醛及紫色杆菌素,少量也足以阻碍蛙壶菌的生长。[31]另外,在红背蝾螈身上发现的Lysobacter gummosus可以生产2,4-二乙酰基间苯三酚,也都能阻碍蛙壶菌的生长。[32]
以往一直有指杀虫剂的使用也是导致两栖类减少的原因[33][34][35]。于2007年,这个说法得到肯定。研究发现,当黄腿山蛙暴露在非致命的甲萘威浓度下,会较易感染壶菌病。甲萘威会使牠们皮肤上的缩氨酸防卫大幅削弱,破坏其免疫防御,增加患病的风险。[36]
Daszak P; Berger L; Cunningham AA; Hyatt AD; Green DE; Speare R. Emerging infectious diseases and amphibian population declines. Institute of Ecology, University of Georgia, Athens, GA 30602, USA. 1999.
Piotrowski JS, Annis S, Longcore JE. Physiology of Batrachochytrium dendrobatidis, a chytrid pathogen of amphibians. Mycologia. 2004, 96 (1): 9–15.
Woodhams DC, Alford RA, Marantelli G. Emerging disease of amphibians cured by elevated body temperature. Dis. Aquat. Org. June 2003, 55 (1): 65–7. PMID 12887256. Longcore JE, Pessier AP, Nichols DK. Batrachochytrium Dendrobatidis gen. et sp. nov., a chytrid pathogenic to amphibians. Mycologia. 1999, 91 (2): 219–227.
Moss AS, Reddy NS, Dortaj IM, San Francisco MJ. Chemotaxis of the amphibian pathogen Batrachochytrium dendrobatidis and its response to a variety of attractants. Mycologia. 2008, 100 (1): 1–5. PMID 18488347. doi:10.3852/mycologia.100.1.1. Symonds EP, Trott DJ, Bird PS, Mills P. Growth characteristics and enzyme activity in Batrachochytrium dendrobatidis isolates. Mycopathologia. 2008, 166 (3): 143–147.
Berger L, Hyatt AD, Speare R, Longcore JE. Life cycle stages of the amphibian chytrid Batrachochytrium dendrobatidis. Dis. Aquat. Org. December 2005, 68 (1): 51–63. PMID 16465834. doi:10.3354/dao068051. Di Rosa, Ines; et al. The Proximate Cause of Frog Declines?. Nature. 2007, 447 (31): E4–E5.
Daszak, P.; Cuningham, A. A. & Hyatt, A.D. Infection disease and amphibian population declines. Divers. Distrib. 2003, 9: 141–150.
Kats LB, Ferrer RP. Alien predators and amphibian declines: review of two decades of science and the transition to conservation. Diversity and Distributions. 2003, 9: 99–110.
Daszak P, Strieby A, Cunningham AA, Longcore JE, Brown CC, Porter D. Experimental evidence that the bullfrog (Rana catesbiana) is a potential carrier of chytridiomycosis, an emerging fungal disease of amphibians. Herpetological Journal. 2004, 14: 201–207.
Johnson ML, Speare R. Possible modes of dissemination of the amphibian chytrid Batrachochytrium dendrobatidis in the environment. Dis. Aquat. Org. July 2005, 65 (3): 181–6. PMID 16119886. Herrera RA, Steciow MM, Natale GS. Chytrid fungus parasitizing the wild amphibian Leptodactylus ocellatus (Anura: Leptodactylidae) in Argentina. Diseases of Aquatic Organisms. 2005, 64: 247–52.
Schloegel LM, Hero JM, Berger L, Speare R, McDonald K, Daszak P. The decline of the sharp-snouted day frog (Taudactylus acutiostris): the first documented case of extinction by infection in a free-ranging wildlife species?. EcoHealth. 2006, 3: 35–40.
Reeves MK. Batrachochytrium dendrobatidis in wood frogs (Rana sylvatica) from Three National Wildlife Refuges in Alaska, USA. Herpetological Review. 2008, 39 (1): 68–70.
Andre SE, Parker J, Briggs CJ. Effect of temperature on host response to Batrachochytrium dendrobatidis infection in the mountain yellow-legged frog (Rana muscosa). Journal of Wildlife Diseases. 2008, 44 (3): 716–20.
Byrne MW, Davie EP, Gibbons JW. Batrachochytrium dendrobatidis occurrence in Eurycea cirrigera. Southeastern Naturlaist. 2008, 7 (3): 551–5.
Brodman R, Briggler JT. Batrachochytrium dendrobatidis in Ambystoma jeffersonianum larvae in southern Indiana. Herpetological Review. 2008, 39 (3): 320–1.
Lehtinen RM, Kam Y-C, Richards CL. Preliminary surveys for Batrachochytrium dendrobatidis in Taiwan. Herpetological Review. 2008, 39 (3): 317–8.
Lovich R, Ryan MJ, Pessier AP, CLaypool B. Infection with the fungus Batrachochytrium dendrobatidis in a non-native Lithobates berlandieri below sea level in the Coachella Valley, California, USA. Herpetological Review. 2008, 39 (3): 315–7.
Bovero S, Sotgiu G, Angelini C, Doglio S, Gazzaniga E, Cunningham AA, Garner TWJ. Detection of chytridiomycosis caused by Batrachochytrium dendrobatidis in the endangered sardinian newt (Euproctus platycephalus) in Southern Sardinia, Italy. Journal of Wildlife Diseases. 2008, 44 (3): 712–5.
Brucker RM, Harris RN, Schwantes CR, Gallaher TN, Flaherty DC, Lam BA, Minbiole KP. Amphibian chemical defense: antifungal metabolites of the microsymbiont Janthinobacterium lividum on the salamander Plethodon cinereus. J. Chem. Ecol. November 2008, 34 (11): 1422–9. PMID 18949519. doi:10.1007/s10886-008-9555-7. Brucker RM, Baylor CM, Walters RL, Lauer A, Harris RN, Minbiole KP. The identification of 2,4-diacetylphloroglucinol as an antifungal metabolite produced by cutaneous bacteria of the salamander Plethodon cinereus. J. Chem. Ecol. January 2008, 34 (1): 39–43. PMID 18058176. doi:10.1007/s10886-007-9352-8. Cohen, Nathan W.; Stebbins, Robert A. A Natural History of Amphibians. Princeton, N.J: Princeton University Press. 1995. ISBN 0-691-10251-1. Daividson C, Shaffer HB, Jennings MR. Declines of the california red-legged frog: climate, UV-B, habitat, and pesticides hypotheses. Ecological Applications. 2001, 11 (2): 464–79.
Hayes TB, Case P, Chui S, Chung D, Haeffele C, Haston K, Lee M, Mai VP, Marjuoa Y, Parker J, Tsui M. Pesticide mixtures, endocrine disruption, and amphibian declines: are we underestimating the impact?. Environ. Health Perspect. April 2006,. 114 Suppl 1: 40–50 [2009-09-09]. PMC 1874187  . PMID 16818245. (原始内容存档于2009-01-18).
. PMID 16818245. (原始内容存档于2009-01-18). Davidson C, Benard MF, Shaffer HB, Parker JM, O'Leary C, Conlon JM, Rollins-Smith LA. Effects of chytrid and carbaryl exposure on survival, growth and skin peptide defenses in foothill yellow-legged frogs. Environ. Sci. Technol. March 2007, 41 (5): 1771–6. PMID 17396672.

