醋酸格拉替雷
来自维基百科,自由的百科全书
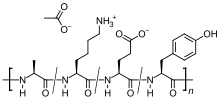
醋酸格拉替雷(INN:glatiramer acetate)是一种由丙氨酸、谷氨酸、赖氨酸和酪氨酸等四种氨基酸组成的大小不同多肽混合物,属于非生物复合药物[6][7]。它是一种治疗多发性硬化症的免疫调节药物,透过控制发炎反应达到免疫调节的效果,保护神经并减少疾病的复发[1][2][8][9],此外,它的结构与髓鞘碱性蛋白类似,因此可能使攻击它的自体抗体失效[10]。主要针对复发型多发性硬化症,包括:临床单一症候群、复发缓解型和活动性续发进行性多发性硬化症[11]。
 | |
| 临床资料 | |
|---|---|
| 商品名 | Copaxone[1],Glatopa[2],Brabio |
| 其他名称 | Copolymer 1,Cop-1 |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a603016 |
| 核准状况 | |
| 怀孕分级 |
|
| 给药途径 | 皮下注射 |
| ATC码 | |
| 法律规范状态 | |
| 法律规范 |
|
| 识别信息 | |
| CAS号 | 147245-92-9 |
| PubChem CID | |
| DrugBank | |
| ChemSpider |
|
| UNII | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.248.824 |
| 化学信息 | |
| 化学式 | C25H45N5O13 |
| 摩尔质量 | 623.66 g·mol−1 |
醋酸格拉替雷已获美国食品药物管理局 (FDA) 批准用来治疗多发性硬化症,可以减少疾病的复发,但无法阻止病情恶化或减缓残疾。观察性研究(而非随机对照试验)显示它可能会减缓残疾进展。虽然多发性硬化症的诊断,通常需要等待病情反复发作(两次或以上)后才能确定,但有时会在第一次发作时就使用此药,预防疾病恶化。给药方式为皮下注射[1][2]。
常见副作用包括注射部位疼痛、皮疹、呼吸急促和胸痛[12]。其他副作用包括可能潮红、焦虑、脂肪萎缩和肝功能异常[12]。虽然孕期使用对胎儿无明显伤害,但安全性仍不明确[13]。
此药物已列入世界卫生组织基本药物标准清单之中[14]。
历史
醋酸格拉替雷首次由以色列魏兹曼科学研究学院发现。并进行3项主要临床试验以证明其安全性和有效性:第1项试验为单中心、双盲、安慰剂对照试验,参与试验的患者有50名[15]。第2项试验为前后共两年的多中心、随机、双盲、安慰剂对照试验,参与的有251名患者[16]。第3项试验为双盲磁振造影(MRI)研究,参与的有239名患者[17]。
医疗用途
醋酸格拉替雷适用于治疗成人复发型多发性硬化症,包括临床上孤立症候群、复发缓解型和活动性2级进行性型[1]。
考科蓝合作组织于2010年发表的综述,结论是醋酸格拉替雷对"复发型相关的临床结果"具有部分疗效,但对治疗疾病进展无效[18]。因此FDA批准其用于降低复发频率,但不适用于减缓残疾进展[1][2]。
针对前述原试验进行过为期15年的随访,将继续使用醋酸格拉替雷的患者和退出试验的患者进行比较。继续使用醋酸格拉替雷的患者的复发率降低,残疾进展减缓,发展为2级进行性MS的风险降低。 然而这不再是一项随机对照试验,因此不具有可比性。并没发现任何长期使用此药物会产生安全性问题[19]。
不良反应

使用后出现的不良副作用是大约有30%的使用者出现注射部位肿块(注射部位反应),以及约10%的使用者出现疼痛、发烧、发冷(类似流行性感冒症状)[20]。副作用症状通常轻微。有报告指出在注射后不久,有高达5%的患者会出现潮红、呼吸急促、胸痛、焦虑和心跳加速的反应[11](通常是因意外注射入静脉后发生)。这类副作用在30分钟内会消退。在重复注射部位因局部脂肪组织遭到破坏,可能会出现凹陷(称为脂肪萎缩)。虽然孕期使用无明显危害,但安全性尚未充分研究[21]。
根据FDA发布开立处方的资讯,醋酸格拉替雷也可能引起较严重的副作用,如对循环系统、消化系统(含肝脏损伤)、造血系统、淋巴系统、肌肉骨骼系统、神经系统、呼吸系统、泌尿生殖系统以及特殊感官(尤其是眼睛)的严重副作用。 也有报导指出会导致代谢和营养失调,然而尚未证实醋酸格拉替雷与这些不良反应之间存在关联[1][2]。
此药物也可能引发皮肤淋巴组织增生症[22]。
作用机转
醋酸格拉替雷是一种随机聚合物(平均分子质量为16.4千道尔顿(kDa)),由髓鞘碱性蛋白中的四种氨基酸(麸胺酸、离氨酸、丙胺酸和酪氨酸)组成的随机大小肽混合物。 髓鞘碱性蛋白是神经元髓鞘中的抗原,会在多发性硬化症患者体内刺激自体免疫反应,因此肽的作用可能是作为诱饵,引发攻击性免疫细胞发挥作用。
虽然醋酸格拉替雷的作用机制尚未完全阐明,据信其作用机制是调节多发性硬化症发病机制的免疫过程。给药醋酸格拉替雷后,可将T细胞群体从促炎性Th1细胞转变为抑制炎症反应的调节性Th2细胞[23]。此过程是通过抑制Th1细胞分泌促炎性细胞因子(IL-1、IL-12、TNF、INFγ),而诱导Th2细胞穿过血脑屏障并产生抗炎性细胞因子(IL-4、IL-5、IL-13、IL-10、TGF-β)来达成[24]。由于醋酸格拉替雷与髓鞘碱性蛋白相似,而可能成为诱饵,将针对髓鞘的自身免疫反应转移。 在实验性自身免疫性脑脊髓炎 (EAE)的动物实验模型的研究中 - 此病症经由免疫动物体内含有髓鞘的中枢神经系统衍生物质而诱发 - 而得支持前述假设的结果。在动物和体外系统的研究中,显示施用醋酸格拉替雷后,在周边诱导产生专门针对自身的调节性T细胞 (Tregs),并激活它们,以抑制对髓鞘碱性蛋白的攻击[1][2]。
然而血脑屏障的完整性不受醋酸格拉替雷显著影响,至少在治疗早期阶段如此。 临床试验显示醋酸格拉替雷可减少多发性硬化症发作的频率和严重程度[25]。
社会与文化
醋酸格拉替雷已获全球多国批准上市,包括美国、以色列、加拿大和24个欧盟国家[26][27]。此药物在1997年获准在美国用于医疗用途[28]。于2000年8月在英国获准上市(首次在欧洲市场获准),并于同年12月推出[29]。随后通过相互承认程序在欧盟各国获得批准。 伊朗正推动在其国内生产[30][31]。
诺华制药子公司山德士制药自2015年开始销售品牌名称为Glatopa的通用名药物,Glatopa为梯瓦制药生产的20毫克制剂的仿制品,需每天注射[32]。
梯瓦制药本身开发出一种长效的40毫克制剂,于2015年上市,每周注射3次即可[33]。FDA于2017年10月批准另一通用名药物 - 由印度Natco Pharma制药制造,并由荷兰公司迈兰制药负责进口和销售[34][35]。山德士制药制造的通用名药物(每剂40毫克剂量)于2018年2月获得FDA批准[36]。而有制造通用名药物业者对梯瓦制药在长效40毫克产品的专利申请提出异议,因为如果其中任何一项申请得到核准,将会阻止其他药厂的类似长效产品上市[37]。
虽然梯瓦制药在药物化学方面的专利于2015年到期,[38]但它又获得涵盖长效药剂释放的新专利[39]。由制药界竞争对手于2016年至2017年期间发起的诉讼,导致前述梯瓦制药新专利被认定无效[40][41]。美国联邦巡回上诉法院于2018年10月维持专利无效判决,理由是申请的内容非创造性,且显而易见(参见创造性和非显而易见性)[42][43]。该案例反映出品牌药厂所采"常青树策略"中更深层次具争议性的本质。欧盟执行委员会于2024年10月31日对梯瓦制药处以4.626亿欧元的罚款,理由为"该公司滥用专利制度并诋毁竞争对手,以延误其他治疗多发性硬化症药物的生产(梯瓦企图滥用专利制度和发动针对其他格拉替雷生产商的误导性宣传活动来阻碍别它们进行生产)"[44]。
参考文献
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
