取自囊胚中內細胞群的多能性幹細胞 来自维基百科,自由的百科全书
胚胎幹細胞(Embryonic stem cell,簡稱ESC)是一類具有多能性的幹細胞。在卵細胞受精後,受精卵經過桑葚胚階段,進入囊胚階段。囊胚中的細胞可以歸入兩個大類:滋養層(trophoblast,TE)和內細胞群(inner cell mass,ICM)。滋養層的細胞會分化爲胚胎外的組織(胎盤等),內細胞群的細胞則會分化成胚胎的其餘結構。分離內細胞群細胞並進行體外(in vitro)培養,即可取得胚胎幹細胞。胚胎幹細胞擁有分化爲三個胚層的細胞的潛能,或者說在一般情況下能分化形成除了胎盤之外的所有胚胎結構,此為胚胎幹細胞多能性的具體體現。
1981年,英國劍橋大學遺傳學部中,兩個分別由馬丁·埃文斯(Martin Evans)以及馬修·考夫曼(Matthew Kaufman)率領的研究團隊分別在體外建立了小鼠胚胎幹細胞系[1]。而胚胎幹細胞這一術語則是由加州大學三藩市分校(UCSF)解剖學部的教授蓋爾·馬丁(Gail R. Martin)於當年12月的一篇論文中首次提出[2]。1998年,威斯康星大學教授詹姆斯·湯姆森(James Thomson)等人成功建立了人胚胎幹細胞系。2007年,馬丁·埃文斯與另外兩名科學家因「利用胚胎幹細胞引入特異性基因修飾的原理上的發現」而獲得當年諾貝爾生理學或醫學獎。
胚胎幹細胞被認爲在再生醫學、組織工程、藥物實驗等領域擁有廣闊的應用前景,胚胎幹細胞對發育生物學的基礎研究也有很大助益。但是,因爲道德、宗教與法律上的問題(比如目前分離胚胎幹細胞的方法會無可避免地殺死胚胎),有關胚胎幹細胞的研究(即治療性克隆)在各國都受到了一定的限制[3][4]。

胚胎幹細胞來自囊胚的內細胞群(ICM),並進行體外(in vitro)培養取得。胚胎幹細胞具有多能性,在一定條件下能夠分化爲三個胚層(外胚層、中胚層、內胚層)的細胞,形成生物體的各種結構。胚胎幹細胞的形態與基因表達情況與其他細胞有明顯的不同[5]:8[6]。
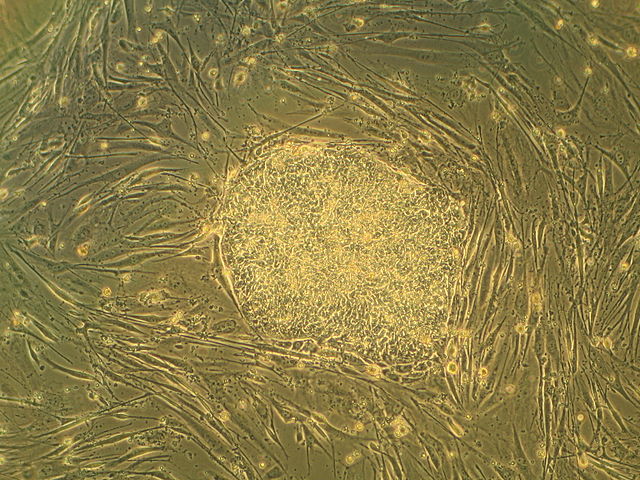
胚胎幹細胞爲球狀,人胚胎幹細胞直徑約爲14μm,而鼠胚胎幹細胞直徑約爲8μm[7]。胚胎幹細胞的細胞核一般較大,核仁明顯,而細胞質相對較少。人和小鼠的胚胎幹細胞都能在培養皿上形成圓形、邊界清晰、表面光滑的細胞集落[5]:8。
胚胎幹細胞多能性的維持依賴於SOX2、Oct4、Nanog等因子構成的轉錄網絡,確保與細胞自我更新能力有關的基因能夠持續高水平表達,並抑制與分化、自噬相關的基因轉錄。在胚胎幹細胞的分化過程中,細胞的基因表達情況會發生很大變化,尤其是與胚胎幹細胞自我更新能力維持有關的基因[5]:29-36[6]。
胚胎幹細胞的自我更新和分化與表觀遺傳學途徑有密不可分的聯繫。首先是組蛋白的化學修飾:在胚胎幹細胞中,與自我更新相關的基因所在區域組蛋白H3K27高度乙酰化,這些區域中既有組蛋白乙酰基轉移酶,也有去乙酰化酶。這兩種作用效果完全相反的酶使H3K27的乙酰化水平維持動態平衡,便於基因能在外界信號發生改變時迅速關閉。另外,PRC1與PRC2兩種重要的蛋白質會使H3K27、H3K4發生甲基化而沉默與分化相關的基因,使其不表達。胚胎幹細胞多能性的維持與RNA干擾也有緊密聯繫。比如,PRC1與PRC2還會沉默編碼與分化相關的miRNA,使胚胎幹細胞維持多能性;而let-7(一種miRNA)的表達則會使胚胎幹細胞開始分化。受精卵發育早期,基因組所有的DNA甲基化都會由甲基轉移酶Dmnt1消除;而與胚胎幹細胞自我更新有關的基因區域會在分化過程中再次甲基化,這些基因的表達也隨之停止[5]:29-36[6]。
胚胎幹細胞多能性的維持還需要依靠胞外微環境提供適宜的信號,否則,胚胎幹細胞很容易分化爲其他類型的細胞。過去,胚胎幹細胞的培養需要在有一層餵養層細胞的培養基上進行。餵養層細胞一般是經絲裂黴素等有絲分裂阻斷劑處理過的胚胎成纖維細胞,這些細胞能分泌特定的信號分子模擬早期胚胎發育的微環境,使胚胎幹細胞維持不分化的狀態。目前,在培養基內加入白血病抑制因子(LIF)等細胞信號分子就能夠在無餵養層的培養基上培養胚胎幹細胞[8][6]。

分離囊胚的內細胞群(ICM)細胞,再進行體外培養即可取得胚胎幹細胞。目前,取得胚胎幹細胞的方法已有一定改進,但仍無可避免地會殺死胚胎[5]:5。
囊胚由兩大部分構成:處於外圍的滋養層以及處於內部的內細胞群。滋養層細胞會分化爲胚胎外的組織(胎盤等),而內細胞群則會分化爲胚胎的各種結構[5]:3-5。
最早期分離胚胎幹細胞的方法是先用蛋白酶分解透明帶的蛋白質(囊胚外圍的一層細胞外基質),再利用免疫手術(immunosurgery)專一地使滋養層細胞裂解,從而取得內部的內細胞群細胞,之後體外培養和繁殖取得的內細胞群細胞,即可建立胚胎幹細胞系[10][11]。目前胚胎幹細胞的分離方法已有了一定的改進,比如現在已有使用激光去除透明帶的技術[5]:5。
獲取胚胎幹細胞的成功率相當低,即使成功取得胚胎幹細胞,維持其不分化的狀態也十分困難。爲了阻止胚胎幹細胞在培養過程中分化,培養基需加入如白血病抑制因子(LIF)等因子。最初,胚胎幹細胞需要在含有餵養層細胞的培養基上培養。餵養層細胞能爲胚胎幹細胞提供特定的微環境,以抑制胚胎幹細胞的分化。餵養層細胞常常使用經過有絲分裂阻斷劑(如絲裂黴素)處理過的胚胎成纖維細胞[8]。目前已能在成份清楚、無異物、不含有血清以及餵養層細胞的培養基上培養胚胎幹細胞[5]:5。
胚胎幹細胞可以通過細胞集落或細胞本身的形態初步鑑定;除此之外,還可以從分子標記和分化潛能等兩方面對胚胎幹細胞進行鑑定[5]:8。
各基因的表達情況隨細胞不同而異。因此,可以用一些在細胞中特異性表達的蛋白質對胚胎幹細胞進行鑑定。上述特異性表達的蛋白質又分爲兩種類型:細胞內的蛋白質以及細胞表面特異性的蛋白質(細胞表面標記)。目前較常用的細胞表面標記有SSEA-3、SSEA-4、TRA-1-60和TRA-1-81(前兩者為階段特異性胚胎表面抗原,後兩者為腫瘤識別抗原);而常選為分子標記的細胞內蛋白質則有Oct4和Nanog等。免疫組織化學技術利用能與這些分子標記特異性結合的抗體來鑑定胚胎幹細胞,此外,這種技術也能與流式細胞分選術、免疫磁珠等方法結合,用於胚胎幹細胞的分離[12][13][5]:8。
特異性分子標記的篩選可以採用轉錄組學與蛋白質組學的技術,將胚胎幹細胞與其他細胞比對,以篩選出在胚胎幹細胞中特異性表達的蛋白質[12]。
檢驗分化潛能也可以達到鑑定胚胎幹細胞的目的。例如將小鼠的胚胎幹細胞注射入其他的小鼠胚胎中,再使這個胚胎發育爲完整個體,如果注射的胚胎幹細胞具有多能性,最後就能形成嵌合體(即該小鼠的一部分細胞基因型與其他部分不同,該部分細胞來自注射的胚胎幹細胞)。但是,考量倫理等方面的議題,上述方法並不適用於人類等動物。鑑定人胚胎幹細胞的分化潛能主要有兩種方法:體外培養形成擬胚體(embryoid body,EB)或注射入小鼠體內形成畸胎瘤。在體外低黏附性培養皿上培養人胚胎幹細胞(或者懸浮培養人胚胎幹細胞)能使胚胎幹細胞形成一種特殊的結構,稱為擬胚體,形成擬胚體的胚胎幹細胞會分化爲三大類分別具有外胚層、中胚層、內胚層細胞特徵的細胞,利用不同的分子標記即可鑑定這三個胚層的細胞。如果將人胚胎幹細胞注射入小鼠體內,則可以觀察到畸胎瘤的形成,畸胎瘤的一些特徵與早期胚胎相似,含有三大類分別具外胚層、中胚層、內胚層細胞特徵的細胞[5]:8-12。
1964年,劉易斯·克萊因史密斯(Lewis Kleinsmith)和巴里·皮爾斯(G. Barry Pierce Jr.)從畸胎瘤(一種生殖細胞病變後形成的腫瘤)中分離出了一種細胞[14],這種細胞擁有生長和分裂的能力,現在稱這種細胞為胚胎腫瘤細胞(embryonal carcinoma cells,EC cells)[15]。胚胎腫瘤細胞形態與後來發現的胚胎幹細胞相似,而且也具有多能性,因此過去曾作為小鼠的早期發育研究模式。但實際上這類細胞並不是十分理想的研究模型[16]。

1981年,英國劍橋大學遺傳學部兩個分別由馬丁·埃文斯以及馬修·考夫曼(Matthew Kaufman)領導的研究團隊分別獨立在體外建立了小鼠胚胎幹細胞系,他們的論文於當年7月發表[1]。而「胚胎幹細胞」這一術語最早則由加州大學三藩市分校(UCSF)解剖學部的蓋爾·馬丁(Gail R. Martin)教授於當年12月的一篇論文中提出[2]。她證明胚胎可以在體外培養,而且可以從中分離出胚胎幹細胞。1989年,馬里奧·卡佩奇、馬丁·埃文斯和奧利弗·史密斯三人對胚胎幹細胞使用基因工程技術,製造出了第一隻基因敲除小鼠。1998年,威斯康星大學教授詹姆斯·湯姆森(James Thomson)等人成功建立了人胚胎幹細胞系,爲胚胎幹細胞研究的又一突破[17]。
2006年,日本京都大學的山中伸彌課題組發表了一種方法,藉由導入四個外源性基因(Oct3/4、Sox2、c-Myc、Klf4)誘導體細胞轉化爲人工誘導多能幹細胞(iPSC)。iPSC比胚胎幹細胞多了許多優勢——iPSC在分化潛能、形態學等方面與胚胎幹細胞的性質相似,但涉及的倫理道德爭議較小,且可產生與個人基因型相同的多能幹細胞[18]。
2009年1月23日,美國食品藥品監督管理局(FDA)批准了一項I期臨床試驗,該試驗將分化自胚胎幹細胞的寡突膠細胞(oligodendrocyte,一種中樞神經系統中的細胞)移植入脊髓損傷的患者體內。這是世界首例應用人胚胎幹細胞的臨床實驗[19],該項研究由加州大學爾灣分校(UCI)的漢斯‧柯爾斯特德(Hans Keirstead)及他的同事們主持,邁克爾·D·維斯特博士(Michael D. West, Ph.D)創立的加州門洛帕克傑龍公司(Geron Corporation)爲這項研究提供資助。此前用大鼠進行的研究表明,脊髓損傷的大鼠接受由人胚胎幹細胞分化成的寡突膠細胞移植7天後,運動能力得到了一定恢復[20]。這一療法的I期臨床試驗計劃徵募8到10名截癱病人,他們都是在試驗開始前兩週以內受傷的,因爲細胞需要在瘢痕組織開始生長前注射。研究者強調,即使注射了這種細胞,基本上也不可能完全恢復病人的運動能力。該階段的試驗旨在測試該療法的安全性,如果進展順利,下一步他們將會讓病情更嚴重的患者試用這一療法[21]。2009年8月,FDA下令暫停這項試驗,因爲一部分接受這種療法的大鼠在顯微鏡下觀察到長出了囊腫。2010年7月30日,這項研究獲許繼續進行。2010年10月,研究者在亞特蘭大的牧者中心(Shepherd Center)對第一名病人施行了該療法[22]。2011年11月,傑龍公司宣佈因爲財政上的原因,暫停這項研究以及相關試驗,但會繼續觀察已接受治療的患者。同時,他們希望能夠找到合作夥伴以繼續這項研究[23]。2013年,由邁克爾D.維斯特博士領導並繼承所有傑龍公司幹細胞資產的BioTime公司,宣佈重啓此前傑龍公司暫停的臨床研究[24]。

胚胎幹細胞具有相當大的分化潛能,這使得胚胎幹細胞可以分化爲人體的各種細胞、組織,乃至器官。這使得胚胎幹細胞在組織工程與再生醫學領域擁有巨大的應用前景[25]。另外,胚胎幹細胞也是發育生物學研究以及藥物試驗的良好材料,利用胚胎幹細胞技術產生的基因敲除小鼠、轉基因小鼠對生物醫學研究也有重要作用[5]:3-5。但是,胚胎幹細胞本身存在的一些缺陷(比如,難以產生與接受者基因型完全相同的胚胎幹細胞,使得可能對生成的細胞發生排異反應),以及倫理、道德、法律等方面的爭議,使得胚胎幹細胞的研究仍面臨着一定的挑戰。另外,山中伸彌等發明的iPSC技術相比胚胎幹細胞在倫理等方面擁有優勢,對胚胎幹細胞的地位亦產生了一定的衝擊[6][26]。
胚胎幹細胞最受關注的潛在用途是它能應用於細胞替代療法(cell replacement therapies,CRT)中。即通過將胚胎幹細胞誘導分化爲心肌細胞、神經元、肝細胞、骨髓細胞、胰島細胞和內皮細胞等,再利用這些細胞替換或補充患者體內死亡或喪失功能的細胞[27]。研究人員已能夠誘導胚胎幹細胞分化爲NK細胞和骨髓組織[28]。另外,研究人員已經能誘導胚胎幹細胞分化爲產生胰島素的細胞。這爲糖尿病的治療帶來了希望[29]。亦有研究者試圖誘導胚胎幹細胞分化爲產生多巴胺的細胞,以治療帕金森綜合症[30][31]。目前,使用胚胎幹細胞的細胞替代療法主要面臨的挑戰有:如何克服因基因型不同而可能產生的免疫排異反應、如何產生足夠數量的細胞、如何誘導幹細胞產生一個完整的器官、植入後的細胞、組織或器官如何與周圍的組織融合,以及如何剔除未分化的幹細胞,以免這些細胞一同移入患者體內,形成腫瘤[32]。
另外,胚胎幹細胞亦可以用於幹細胞治療中。例如,利用基因工程技術將特定具有治療效果的基因導入胚胎幹細胞中,再誘導這些胚胎幹細胞分化爲目標細胞。再將這些工程細胞導入患者體內,可達到治療疾病的目的[32]。胚胎幹細胞使用比體細胞更高效的DNA修復手段,因而相比體細胞,其基因突變率要低得多,這使胚胎幹細胞還有潛力用於DNA損傷的修復[33]。
胚胎幹細胞良好的分化、增殖潛能使其成爲藥物安全性以及藥效試驗的良好材料[34]。目前,已經有使用胚胎幹細胞分化而成的心肌細胞測試藥物對心臟毒性的案例[35]。未分化的胚胎幹細胞也可以用於藥物對發育毒性等的藥物毒理研究[34][36]。

胚胎幹細胞研究,尤其是人胚胎幹細胞的研究常常會引起倫理、道德以及法律上的爭議,大部分國家和地區都對胚胎幹細胞研究施加了一定的限制,惟限制的程度不盡相同[37][38]。
日本、南韓、以色列、伊朗、印度、中國大陸、臺灣對人胚胎幹細胞研究限制較少,且對相關研究予以支持。其中,中國大陸對胚胎幹細胞研究的限制尤其少[37][38]。
大部分南美洲國家(除巴西[39])、非洲國家(除南非[40])都對胚胎幹細胞研究施加較大的限制[38]。
大洋洲的澳大利亞對人胚胎幹細胞研究限制較少,但新西蘭對相關研究的限制則相對較大[41]。
歐盟內部的國家對幹細胞研究的態度截然不同。瑞典、芬蘭、比利時、希臘、英國、丹麥和荷蘭等國目前允許人類胚胎幹細胞的研究(其中英國對胚胎幹細胞研究的限制尤其少),但這類研究在德國、奧地利、愛爾蘭、意大利和葡萄牙等國卻仍然是非法的[38]。
美國沒有任何聯邦法律約束人類胚胎幹細胞研究。但是,由聯邦資助的研究會受到一定程度的限制。根據時任美國總統喬治·布什於2001年簽署的法案,只有於2001年前建立的胚胎幹細胞系(根據這一法案,實際上符合條件的細胞系只有21種)可以用於聯邦資助的研究中。後來巴拉克·奧巴馬總統於2009年廢除禁令,但隨後通過的一項修正案禁止聯邦法案資助會毀壞人類胚胎的研究,也就意味着新的胚胎幹細胞系無法通過聯邦資助的研究獲取。也就是說,聯邦資助的研究可以使用任何已存在的胚胎幹細胞系,但不能在研究中新建胚胎幹細胞系[42]。美國各州對胚胎幹細胞研究的態度也截然不同,部分州完全禁止胚胎幹細胞的研究,比如阿肯色州、印第安納州、路易斯安那州、密歇根州、北達科他州和南達科他州[43]。另外一部分州則會給予相關項目資金資助,比如加利福尼亞州[38]。
胚胎幹細胞一直是科學界與宗教組織爭議的熱點問題之一[44]。另外,胚胎幹細胞研究的合法性在法理學、倫理學等領域也是一個惹人注目的焦點[45][46]。相關爭議在世界上絕大部分國家和地區都存在。其中,美國作爲世界上生物醫學研究水平最高的國家,關於胚胎幹細胞的倫理、宗教、法律爭議尤爲激烈[47]。
取得人胚胎幹細胞必然要破壞人類的胚胎。而基督教的主流觀點一直認爲生命從卵細胞受精就開始了,人無權剝奪胚胎的生命,因此,基督教以及部分支持基督教的組織一直是墮胎和人胚胎研究的反對者[48][49][50]。部分學者認為這也違反了儒家的「仁」並犯了佛家業報[51]。伊斯蘭教對胚胎幹細胞研究(治療性克隆)的態度相對基督教等宗教溫和。根據伊斯蘭教義,毀壞神聖的胚胎是一種罪行,但是毀壞得到靈魂前的胚胎(胚胎得到靈魂的時間是受精4個月後)罪過較輕。在伊朗、埃及等伊斯蘭教國家,人胚胎幹細胞研究是合法的,但仍有一部分穆斯林反對胚胎幹細胞研究或對此表示擔憂,大部分伊斯蘭教國家未對人胚胎幹細胞研究進行立法[52][53]。
政治上,部分保守派反對胚胎幹細胞的研究。比如,反對胚胎幹細胞研究的前美國總統小布殊就曾經說(關於人的)胚胎幹細胞研究「跨越了我們這個社會所應尊重的道德底線」[44][37]。科學研究者,尤其是生物醫學領域的研究者,則對胚胎研究多持支持態度。比如,曾經有33名諾貝爾獎得主在他們寫給美國國會的一封公開信中這樣說:「那些試圖阻止幹細胞帶來的醫療進步的人要對那些飽受可怕疾病折磨的病人和他們的家人負道義上的責任……」[54][47]。另外,有科學家[55]這樣說:「一個僅僅發育了6到7天的早期胚胎,還不能說是一個『人』。它的神經組織遠未發育,沒有知覺,更沒有意識,談不上需要我們的尊重。而解除千千萬萬病人的痛苦,拯救他們寶貴的生命,才是對人類生命的最高尊重。」有英國科學家提出:「細胞研究可以使一些疾病提早5至10年攻克,禁止這項研究反倒不負責任且不道德。」[54]但是,也有部分具有天主教背景的科學家反對胚胎幹細胞的研究,比如美國科學家,斯坦福大學細胞生物學博士特里薩·戴謝爾。她是2009年起訴美國政府允許聯邦資金資助胚胎幹細胞研究的法案的兩名原告之一[56][57]。圍繞胚胎幹細胞研究的法學討論主要圍繞早期胚胎是否具有「人」的權利展開[46][45]。
Seamless Wikipedia browsing. On steroids.