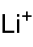氨基鋰是一種無機化合物,化學式為Li+NH2-。它由鋰離子和氨基陰離子(氨的共軛鹼)構成。它與氫化鋰、亞氨基鋰都是具有良好前景的儲氫材料。
性質
其他胺的鋰鹽可以用類似方法製備,也就是用相應的胺代替液氨:
工業上可由氫化鋰與氨氣反應製得,也可將金屬鋰直接在400℃下與氨氣反應:
熔融的氨基鋰呈綠色,冷卻後恢復白色。在空氣中氨基鋰緩慢分解,對其加強熱則猛烈分解,但不會爆炸。加熱到450℃時,分解為亞氨基鋰和氨氣[1]。
氨基鋰難溶於液氨,可溶於冷水,溶於熱水迅速水解成氫氧化鋰和氨氣。 氨基鋰是很活潑的化合物,具有強鹼性。它們都是親核性鹼,除非氮原子由於空間位阻而無法進攻碳原子(例如LDA)。
結構
氨基鋰是一種白色固體,晶體結構屬四方晶系,晶格常數a=501.6pm,c=1022pm,每個晶胞中含8個LiNH2[1]。
其他氨基鋰
由胺的共軛鹼形成的化合物稱為氨基化物。因此氨基鋰可能也指胺的鋰鹽,例如Li+NR2-。一個常見的例子是二異丙基氨基鋰(簡稱LDA),它在有機合成中是常用的強鹼。
2,2,6,6-四甲基哌啶鋰晶體是四聚體:

此外,雙(1-苯基乙基)氨基鋰晶體是三聚體:

製備醇鹽和金屬氨基化物的混合低聚體也是有可能的。[4]它們與醇鹽和烷基鋰配製成的超強鹼類似。當氮原子與一個鋰原子形成σ鍵並通過孤對電子與另一個金屬原子形成配位鍵時,可以形成環狀的低聚體。
參見
參考資料
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.