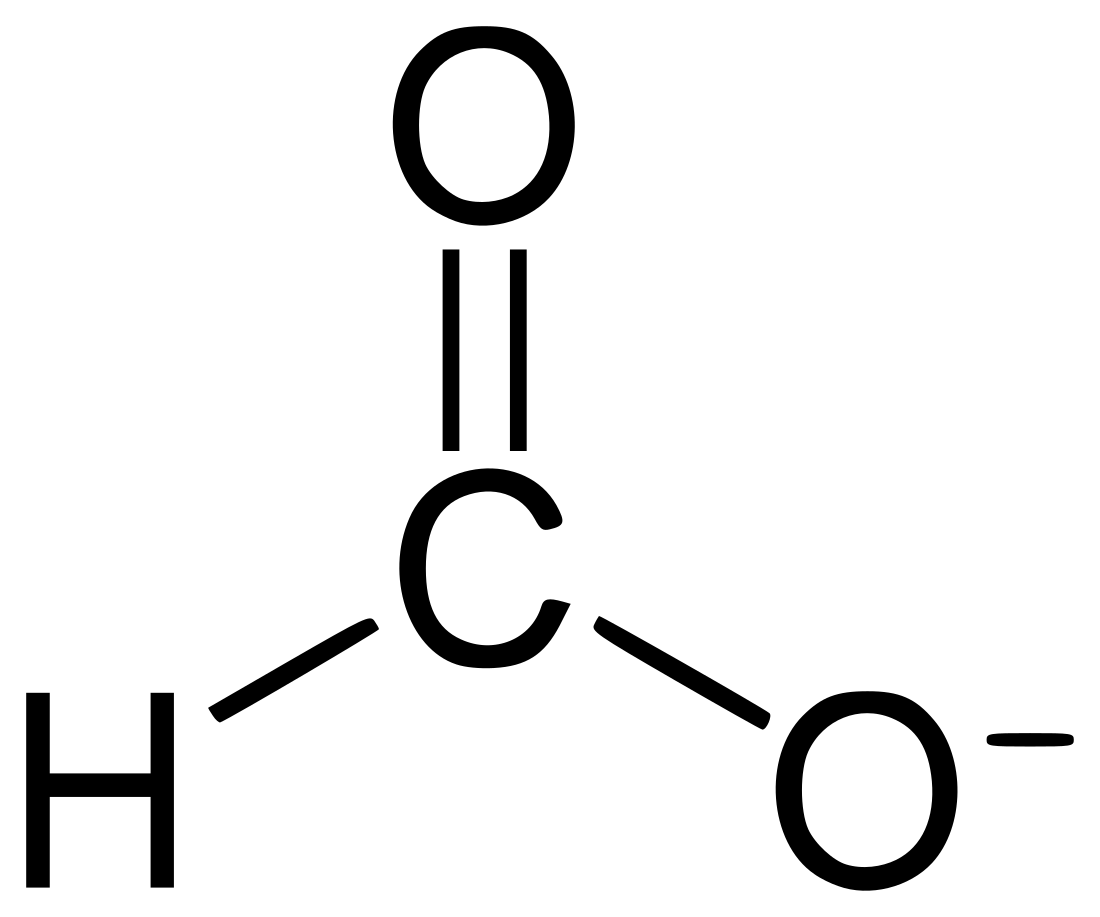
甲酸鹽俗稱蟻酸鹽(英語:Formate)是甲酸根(即蟻酸根,HCOO−)離子和陽離子形成的鹽。此為最簡單的羧酸陰離子。

性質
甲酸鹽一般有較好的溶解性,如甲酸鈉、甲酸鉀等。但由於甲酸根具有還原性,和具有氧化性的陽離子所形成的鹽對熱不穩定,會發生自身的氧化還原反應,如甲酸銅。有些甲酸鹽甚至不能存在。
甲酸鹽也可以形成複鹽,如鈣鈦礦結構的[(CH3)2NH2]M(HCOO)3(M=Mn, Co, Ni)。[1]
甲酸鹽在一定溫度可以分解,分解過程總體來說可以分為兩步:[2]
- 2 HCOO− → C2O42- + H2↑
- C2O42- → CO32- + CO
| 鹽類 | 失水溫度 | 轉變溫度 | 草酸鹽 形成溫度 |
分解溫度 | 分解產物 |
|---|---|---|---|---|---|
| NaHCOO | 300 | 400 | Na2CO3 | ||
| KHCOO | 260 | 335 | K2CO3 | ||
| Mg(HCOO)2·2H2O | 110 | 220 | 280 | MgO | |
| Ca(HCOO)2 | 200 | 330 | CaCO3 | ||
| Ba(HCOO)2 | 255 | 290 | BaCO3 | ||
| Cu(HCOO)2·4H2O | 90 | 130 | 150 | CuO、Cu2O | |
| Zn(HCOO)2·2H2O | 90 | 145 | ZnO | ||
| Cd(HCOO)2·2H2O | 80 | 150 | CdO | ||
| Fe(HCOO)2·2H2O | 70 | 120 | Fe2O3 | ||
| Co(HCOO)2·2H2O | 90 | 190 | Co3O4 | ||
| Ni(HCOO)2·2H2O | 100 | 200 | NiO | ||
| Mn(HCOO)2·2H2O | 80 | 100 | 160 | Mn3O4 |
| 鹽類 | 失水溫度 | 轉變溫度 | 草酸鹽 形成溫度 |
分解溫度 | 分解產物 |
|---|---|---|---|---|---|
| NaHCOO | 300 | 475 | Na2CO3 | ||
| KHCOO | 365 | 485 | K2CO3 | ||
| Mg(HCOO)2·2H2O | 90 | 225 | 285 | MgO | |
| Ca(HCOO)2 | 205 | 380 | CaCO3 | ||
| Ba(HCOO)2 | 270 | 330 | 380 | BaCO3 | |
| Cu(HCOO)2·4H2O | 75 | 130 | 165 | Cu、Cu2O | |
| Zn(HCOO)2·2H2O | 60 | 100 | 150 | ZnO | |
| Cd(HCOO)2·2H2O | 60 | 170 | Cd(升華) | ||
| Fe(HCOO)2·2H2O | 70 | 175 | 185 | Fe3O4 | |
| Co(HCOO)2·2H2O | 90 | 220 | Co、CoO | ||
| Ni(HCOO)2·2H2O | 100 | 190 | Ni、NiO | ||
| Mn(HCOO)2·2H2O | 80 | 150 | 220 | MnO |
參考文獻
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.