孤電子對(英語:lone pair,或稱孤對電子)是不與其他原子結合或共享的以共價鍵成對價電子[1]。存在於原子的最外圍電子殼層。可以使用路易斯結構來標識它們。
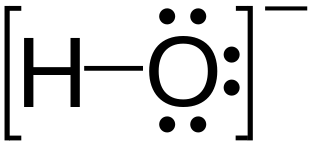
孤對電子在分子中的存在和分配影響分子的形狀等,對氫原子組成的分子影響尤為顯著。指分子中未成鍵的價電子對。

在氮族元素原子中可以找到一個孤電子對,例如氨中的氮,在氧族元素原子中可以找到兩個孤電子對,例如在水中的氧,而鹵素可以攜帶三個孤電子對,例如在氯化氫中。
在價層電子對互斥理論(VSEPR理論)中,水中氧原子上的電子對形成四面體的頂點,而孤電子對在四個頂點中的兩個上。 H–O–H鍵角為104.5°,小於四面體角的109°預測值,這可以通過孤電子對之間的排斥相互作用來解釋[2][3][4]。
參見
參考文獻
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
