四氯化鉿,無機化合物,化學式HfCl4。這種無色固體是大多數有機鉿化合物的前體。它可用於多種特定用途,主要集中於材料科學中,或作為催化劑。
| 四氯化鉿 | |
|---|---|
| |
| IUPAC名 Hafnium(IV) chloride Hafnium tetrachloride | |
| 識別 | |
| CAS號 | 13499-05-3 |
| PubChem | 37715 |
| ChemSpider | 34591 |
| SMILES |
|
| InChI |
|
| InChIKey | PDPJQWYGJJBYLF-XBHQNQODAR |
| 性質 | |
| 化學式 | HfCl4 |
| 摩爾質量 | 320.302 g·mol⁻¹ |
| 外觀 | 白色結晶固體 |
| 密度 | 3.89 g/cm3[1] |
| 熔點 | 432 °C(705 K) |
| 溶解性(水) | 分解[2] |
| 蒸氣壓 | 1 mmHg(190 °C) |
| 結構 | |
| 晶體結構 | 單斜,mP10[1] |
| 空間群 | C2/c, No. 13 |
| 晶格常數 | a = 0.6327 nm, b = 0.7377 nm, c = 0.62 nm |
| 配位幾何 | 4 |
| 危險性 | |
| MSDS | MSDS |
| 歐盟編號 | 未列明 |
| 主要危害 | 刺激性和腐蝕性 |
| 閃點 | 不燃 |
| 相關物質 | |
| 其他陰離子 | 四氟化鉿 四溴化鉿 四碘化鉿 |
| 其他陽離子 | 四氯化鈦 四氯化鋯 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
製備
可以用幾種相近的方法來製備HfCl4:
- HfO2 + 2 CCl4 → HfCl4 + 2 COCl2
- HfO2 + 2 Cl2 + C → HfCl4 + CO2
- HfC+2 Cl2→HfCl4+C
分離鋯和鉿
鉿和鋯通常共生於礦物中,如鋯石、曲晶石和斜鋯石。二氧化鉿(HfO2)的含量在鋯石中為0.05%至2.0%,曲晶石為5.5%至17%,斜鋯石為1.0%至1.8%[8]。鉿和鋯的化合物會從礦石中一併提取,並轉化為四氯化物的混合物。
HfCl4和ZrCl4難以分離,因為鉿和鋯的化合物具有非常相似的化學和物理性質。它們的原子半徑相近:鉿為156.4 pm,而鋯為160 pm[9]。兩種金屬的反應相似,並會形成相似的配合物。
許多方法可從ZrCl4中提煉出HfCl4,包括分餾、分級沉澱、分級結晶和離子交換法。固體氯化鉿的蒸氣壓(從476至681 K)的對數(以10為底數)由下式給出:log10(P) = -5197/T + 11.712,其中壓力的單位為托,溫度的單位為開爾文。(熔點下的壓力為23000托。)[10]
有一種方法基於兩種四鹵化物還原性的差異[8]。選擇性地將鋯化合物還原一至二價,甚至是單質,可以分離四鹵化物。在還原反應中,四氯化鉿基本不反應,並且可從直接從鋯的低鹵化物中回收。四氯化鉿是揮發性的,因此可以很容易地從不揮發的三鹵化鋯中分離出來。
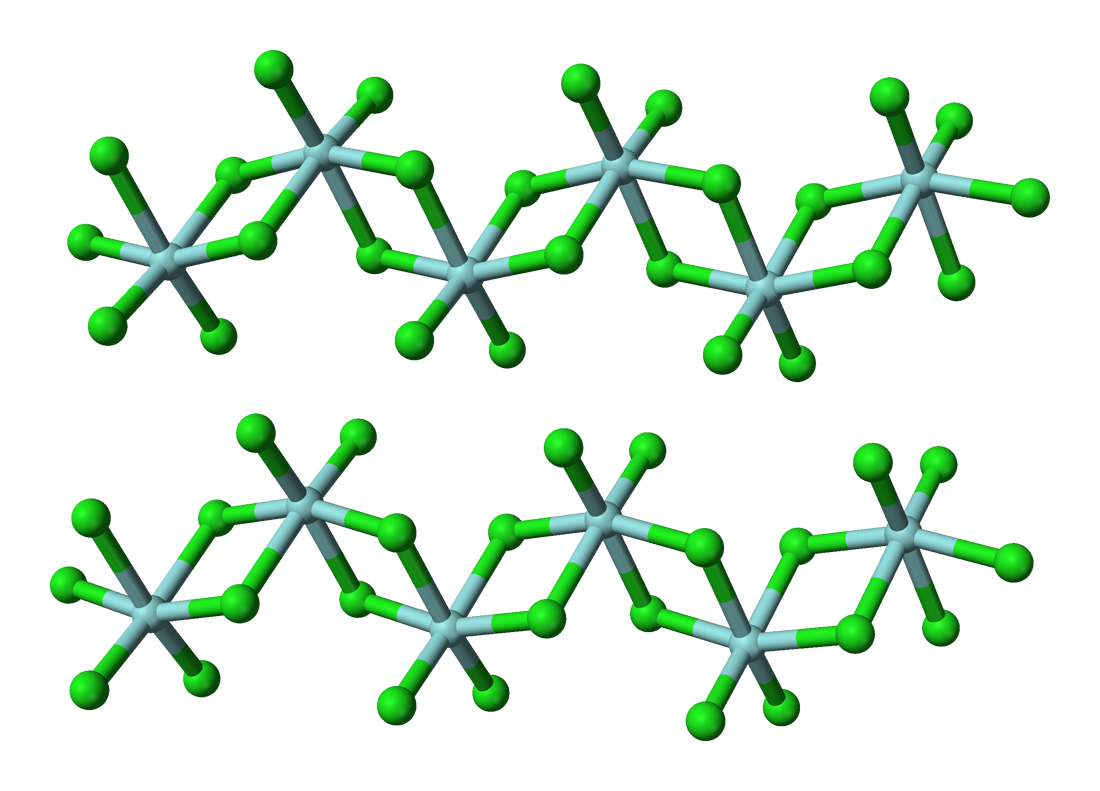
結構及成鍵
此鹵化物含有+4氧化態的鉿。固體HfCl4是八面體鉿中心聚合物。每個鉿中心周圍有六個氯配體,二個為終端,四個橋接至另一個鉿中心。在氣相中,ZrCl4和HfCl4有着與TiCl4相同的單體四面體結構[11]。氣相HfCl4的電子成相研究顯示,Me-Cl核間距為2.33 Å,Cl…Cl核間距為3.80 Å。核間距比r(Me-Cl)/r(Cl…Cl)為1.630,與正四面體模型的預測值(1.633)很接近[9]。
反應特性
該化合物極易水解,並釋放氯化氫:
- HfCl4 + H2O → HfOCl2 + 2 HCl
因而,久置的樣品中常常混有氯氧化物,它也是無色的。
- HfCl4 + 2 OC4H8 → HfCl4(OC4H8)2
因為此配合物可溶於有機溶劑,它是一種製備鉿的其他配合物的有用試劑。
與醇形成醇鹽。
- HfCl4 + 4 ROH → Hf(OR)4 + 4 HCl
這些化合物結構複雜。
HfCl4極難還原。在膦配位體的存在下,可以用鈉鉀合金還原[13]:
- 2 HfCl4 + 2 K + 4 P(C2H5)3 → Hf2Cl6[P(C2H5)3]4 + 2 KCl
用途
四氯化鉿是高活性的齊格勒-納塔催化劑的前體,用於烯烴,特別是丙烯的聚合中[14]。典型的催化劑由四苄基鉿衍生而來。
在各種有機合成應用中,HfCl4是一種高效的路易斯酸。例如,相比使用氯化鋁,用四氯化鉿能使二烯丙基氯矽烷更高效地烷基化二茂鐵。大尺寸的Hf可以減小HfCl4與二茂鐵配合的傾向。[15]
HfCl4可以加速1,3-偶極環加成,並對其加以控制[16]。與芳基和脂族醛肟一起使用時,相比其它路易斯酸,能得到更好的結果,並可生產外異構體。
HfCl4曾作為化學氣相沉積和原子層沉積的一種前體,以生成二氧化鉿和矽酸鉿,它們在製造現代高密度集成電路時用作高κ電介質[17]。然而,由於其相對較低的揮發性和腐蝕性的副產物(即HCl),HfCl4為金屬有機前體所淘汰,例如四(乙基甲基氨基)鉿(TEMAH)[18]。
參考
擴展閱讀
外部連結
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.