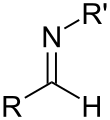
亞胺(英語:imine)是一種含碳-氮雙鍵的官能團或有機化合物,通式為:R1R2C=NR3,其中氮原子連接一個氫原子(H)或一個有機基團(R3),碳原子則與另兩個基團以單鍵連接。[1][2][3]

命名與分類
亞胺可視為醛或酮中氧原子被NR基團(R可以是氫或有機基團)所取代得到的產物。若NR3中的R3=H,化合物為一級亞胺;若R3=烴基,則化合物為二級亞胺。亞胺是一種可參與多種反應的化合物,其應用在有機化學中隨處可見。[3] 若R3=OH,則稱為:肟;若R3=NH2,則稱為:腙。
當一級亞胺的碳原子同時連接了一個烴基和一個氫原子(H)則稱為:一級醛亞胺;二級亞胺具有這樣的形式則稱為:二級醛亞胺。[4]
一級亞胺的碳原子連接了兩個烴基則稱為:一級酮亞胺;二級亞胺具有這種形式則稱為:二級酮亞胺。 [5]
-
一級醛亞胺
-
二級醛亞胺
-
一級酮亞胺
-
二級酮亞胺
 |
亞胺有許多別名,它們不按照IUPAC命名法進行命名。若亞胺的R3為烷基或芳基取代基,則稱之為:希夫鹼,其為紀念化學家雨果·希夫。希夫鹼的生成是酶與底物結合的常見形式。酶的伯胺殘基會進攻底物上的羰基(醛或酮),形成穩定的中間產物施夫鹼。例如:醛縮酶與1,6-二磷酸果糖的結合,生成3-磷酸甘油醛和磷酸二羥丙酮。
亞胺的合成
製備亞胺的典型方法是通過伯胺和醛發生縮合反應(與酮縮合相比較少見)。該反應機理是胺的孤對電子先進攻羰基發生親核加成,得到半縮醛胺(-C(OH)(NHR)-)中間體,而後繼續消除一分子水得到亞胺(更詳細的機理參見烷基亞胺去氧雙取代反應)。由於反應平衡更傾向於羰基化合物與胺一側,因此反應過程需要共沸蒸餾、回流分水或使用脫水試劑如:分子篩,以使平衡向形成亞胺化合物的方向移動。
下列為合成亞胺的一些方法:
亞胺的反應
亞胺參與的最重要的反應為水解反應,即合成相應的胺與羰基化合物的反應,其他亞胺參與的反應大多類似於醛與酮類化合物的反應。
- 亞胺與另一分子胺反應得到縮醛胺,例如合成:瓜環。
- 在氮雜雙烯狄爾斯–阿爾德反應中,亞胺與二烯烴反應得到四氫吡啶。
- 亞胺可與間氯過氧苯甲酸(mCPBA)發生氧化反應得到氧雜氮雜環丙烷。
- 在Povarov反應中,芳香亞胺與烯醇醚反應得到喹啉。
- 氮雜-貝里斯-希爾曼反應中,對甲苯磺酰亞胺與α,β-不飽和羰基化合物反應得到烯丙基胺。
- Eschweiler-Clarke反應中,胺與甲酸進行烷基化反應過程中,亞胺作為中間體存在。
- 亞胺可作為中間體參與糖化學中的重排反應,如:Amadori重排反應。
- 亞胺可通過不穩定的鋶葉立德,發生亞甲基轉移反應從而製備氮丙啶衍生物。
- 還原胺化反應中,亞胺是重要的中間體。
類似於胺類化合物,亞胺具有微弱的鹼性,能夠可逆的質子化得到亞胺鎓離子鹽。亞胺鎓離子衍生物可通過轉移氫化反應或與等當量的氰基硼氫化鈉反應,很容易發生還原得到胺。由於從不對稱酮衍生而來的亞胺具有前手性,因此亞胺是合成手性胺類化合物的常用方法之一。
1973由Kagan第一次發現了亞胺的不對稱還原反應:底物Ph(Me)C=NBn與PhSiH2,在手性配體DIOP和銠催化劑(RhCl(CH2CH2)2)2條件下發生氫化矽烷化反應。[9] 自此之後,又發展出許多針對亞胺的不對稱反應。[10][11]
立體化學
C=N雙鍵的存在可以產生很多立體異構體。為了得到單一的產物,人們發明了很多合成方法。最有名的是托普反應和齊格勒反應(Ziegler's reaction)。
生物作用
亞胺在自然中很常見,如: 維生素B6可促進氨基酸通過亞胺化合物來進行脫氨。
參見
參考文獻
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.