热门问题
时间线
聊天
视角
氯胺
消毒 来自维基百科,自由的百科全书
Remove ads
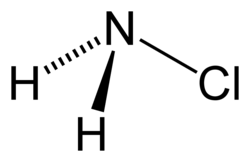
氯胺,又稱氯代氨,是一種無機化合物,為氨中一個(一氯代氨)、二個(二氯代氨)或者三個(三氯化氮)氫原子被氯取代之後得到之氨衍生物。氯胺一詞也指一系列化學式為 R2NCl 及 RNCl2 的有機化合物。
一氯代氨的化學式是NH2Cl,為不穩定的無色液體,熔點−66 °C(−87 °F),通常以水溶液的形式儲存和使用。該溶液有時被用作消毒劑。由於其不穩定性,其沸點無法測量。[1]
Remove ads
水處理
低濃度的NH2Cl在市政供水系統中作為二級消毒劑。其應用與日俱增,並逐漸取代氯氣(在水處理過程中被稱為游離氯)。NH2Cl遠比游離氯穩定,且不易在水中被浪費。相對比起游離氯,其與有機化合物反應形成有機氯化合物的趨勢較小,但依舊存在;這些有機氯化合物包括氯仿和四氯化碳;這些物質在已被確定為致癌物質,美國國家環境保護局從1979年起開始管控飲用水中的這些有機氯化合物的濃度。[2]
與此同時,一些不受管制的副產品有可能造成更大的健康風險。[3]以氯胺淨水亦可能增加飲用水中鉛含量,尤其是對於老舊住宅而言。暴露於此種高鉛濃度的條件下,或導致血液中鉛含量增加,並可能造成重大健康風險。[4]
在游泳池中,氯胺通過游離氯與諸如尿液、汗液、皮膚細胞等物質當中的有機物反應而生成。相對比起游離氯,其殺菌效果較差;而且若不能適當地控制,其對於游泳者的眼睛亦會具有更強的刺激性。氯胺也是游泳池中獨特的「氯」的味道的來源。[5][6]一些為私人游泳池設計的測試工具無法區分游離氯與氯胺,這或導致游泳池中的氯胺濃度不適當。[7]亦有證據顯示,暴露於氯胺會引起游泳者的呼吸道問題,包括哮喘。[8]對於競技游泳運動員,呼吸道問題常見而普遍。[9]
安全性
基於過往數據,美國國家環境保護局(EPA)制定的飲用水水質標準限制公眾供水系統中氯胺含量不得多於 4 ppm。 為了達到EPA規定的鹵化消毒副產物限量標準,許多公用事業部門正在把淨化方式從氯化轉向氯胺化。雖然氯胺化產生的鹵化消毒副產物較少,但可產生更高濃度的未受管控的含碘副產物及N-亞硝基二甲胺;[10][11] 此二者皆已被證明具有遺傳毒性[11]。
用作血液透析[12]、養殖、水耕栽培[13]及自釀啤酒時,應當設法除去水中的氯胺。 在用作透析時,若氯胺進入血液中,可能會導致溶血性貧血。[12] 若水耕栽培的培養液中混入氯胺,則會延緩植物的生長。[13]
製備
氯胺可以透過氨與次氯酸根反應製得:NH3 + ClO− → NH2Cl + OH− [14]。此反應必須在弱鹼性 (pH 8.5–11)的環境下進行。進行反應的氯化劑是次氯酸,其通過氫離子和次氯酸根反應生成,而後參與氨取代產生氫氧根的親核取代反應。此反應在 pH 約為8時反應最快;若 pH 過高,則次氯酸濃度過小;若 pH 過低,則氨形成銨根,而後者不發生上述反應。氯胺可通過真空蒸餾,並將蒸汽通過碳酸鉀(乾燥劑)濃縮。氯胺也可以通過乙醚萃取。
氣態氯胺亦可通過氨氣和氯氣反應得到(過程中用氮氣稀釋):
- 2 NH3(g) + Cl2(g) ⇌ NH2Cl(g) + NH4Cl(s)
- 2 NH2F + CaCl2 → 2 NH2Cl + CaF2
參考文獻
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads