異氰酸
化合物 来自维基百科,自由的百科全书
異氰酸是一種無機化合物,分子式為HNCO,通常寫作 H–N=C=O。它是無色的物質,有揮發性,有毒,沸點為 23.5 °C。為氰酸的互變異構體。
| 異氰酸 | |
|---|---|
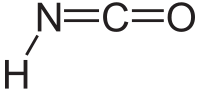
| |

| |
| IUPAC名 Isocyanic acid | |
| 識別 | |
| CAS號 | 75-13-8 420-05-3(氰酸) ? |
| PubChem | 6347 |
| ChemSpider | 6107 |
| SMILES |
|
| InChI |
|
| InChIKey | OWIKHYCFFJSOEH-UHFFFAOYAE |
| 性質 | |
| 化學式 | HNCO |
| 摩爾質量 | 43.03 g·mol⁻¹ |
| 外觀 | 無色液體或氣體(沸點接近室溫) |
| 密度 | 1.14 g/cm3 (20 °C) |
| 熔點 | -86 °C [1] |
| 沸點 | 23.5 °C |
| 溶解性(水) | 可溶 |
| 溶解性 | 可溶於苯、甲苯、醚 |
| 危險性 | |
| 主要危害 | 有毒 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
異氰酸對應的陰離子 [N=C=O]−
和氰酸一樣,也被稱作氰酸鹽。相關的官能團 –N=C=O 叫做異氰酸酯,是氰酸酯 –O–C≡N、雷酸鹽 –O–N+≡C−和氧化腈 –C≡N+–O−的異構體。[2]
異氰酸於 1830年被尤斯圖斯·馮·李比希和弗里德里希·維勒發現。[3]
異氰酸是含有碳、氫、氮和氧這四個在有機化學和生物學中最常見的原子組成的穩定分子裏,最簡單的。它也是四個化學式為 HOCN 的化合物中唯一穩定的,其它三個是氰酸 H–O–C≡N 、雷酸 H–C≡N+–O−[4]和異雷酸 H–O–N+≡C−。[2][5]
結構
儘管根據價鍵理論,異氰酸可以被寫成 HN=C=O,氣態紅外光譜顯示 2268.8 cm−1的震動,由碳-氮三鍵引起。[6][7]因此, H≡C−O− 才是主要的共振異構體。
性質
- HNCO ⇌ H+ + NCO−
- HNCO + H2O → CO2 + NH3
在高濃度下,異氰酸會聚合成三聚體三聚氰酸和1,3,5-三亞胺基-2,4,6-三氧六環,一種聚合物。它們可以簡單地從液態或氣態反應物中分離。三聚氰酸加熱時會分解成異氰酸。[8]
- HNCO + RNH2 → RNHC(O)NH2.
這個反應叫做碳酰胺化反應。
異氰酸有一個互變異構體——氰酸 HOCN,其中氧原子(而不是異氰酸的氮原子)與氫原子連接。它對分解不穩定,但在溶液中和異氰酸形成平衡,有3%的異氰酸以氰酸形式存在。振動光譜表明氮和碳原子之間存在三鍵。[12]
低溫光解含有HNCO的固體可以產生氰酸 H-O-C≡N。[13]人們尚未分離出純氰酸,而異氰酸是所有溶劑中的主要存在形式。[11]
製備
異氰酸可以由氰酸鹽,例如氰酸鉀和氣態氯化氫或是像草酸之類的酸反應而成。[14]
- H+ + NCO- → HNCO
HNCO 也可以由三聚體三聚氰酸熱分解而成:
- C3H3N3O3 → 3 HNCO
- OC(NH2)2 → HNCO + NH3
其中的異氰酸會迅速聚合成三聚氰酸。
存在
參考資料
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
