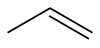
丙烯(英語:Propene,分子式:C3H6),是一種無色可燃氣體,可以通過石油裂解而獲得。在各種烯烴結構中,丙烯為僅次於乙烯較為簡單的烯烴結構。 在大量運輸時,使用加壓液化。丙烯的飽和蒸汽壓在25℃時為1158kPa(華氏度千帕)。
| 丙烯 | |||
|---|---|---|---|
| |||
| |||
| IUPAC名 Propene | |||
| 識別 | |||
| CAS號 | 115-07-1 | ||
| PubChem | 8252 | ||
| ChemSpider | 7954 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | QQONPFPTGQHPMA-UHFFFAOYAA | ||
| UN編號 | 1077 In Liquefied petroleum gas: 1075 | ||
| ChEBI | 16052 | ||
| RTECS | UC6740000 | ||
| KEGG | C11505 | ||
| 性質 | |||
| 化學式 | C3H6 | ||
| 摩爾質量 | 42.08 g·mol⁻¹ | ||
| 外觀 | 無色氣體 | ||
| 熔點 | − 185.2 °C (88.0 K) | ||
| 沸點 | − 47.6 °C (225.5 K) | ||
| 溶解性(水) | 0.61 g/L (? °C) | ||
| 黏度 | 8.34 µPa·s, 16.7 °C | ||
| 結構 | |||
| 偶極矩 | 0.366 D (氣) | ||
| 危險性 | |||
| 歐盟危險性符號 | |||
| 警示術語 | R:R12 | ||
| 安全術語 | S:S9-S16-S33 | ||
| NFPA 704 | |||
| 閃點 | −108°C (−162 °F; 165 K) | ||
| 相關物質 | |||
| 相關烯烴 | 乙烯 丁烯 | ||
| 相關化學品 | 丙烷,丙炔,丙二烯,正丙醇,異丙醇 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
性質
在室溫和標準大氣壓下,丙烯是無色的氣體。並且和許多其它烯烴一樣,丙烯帶有一種較淡但令人不適的氣味。[1]
由於丙烯的分子量大於乙烯,所以丙烯具有高於乙烯的密度和沸點。丙烯的沸點略低於丙烷,所以丙烯的揮發性略強於丙烷。儘管在丙烯分子中沒有強極性鍵,但由於丙烯分子不是完全的對稱,所以丙烯分子仍具有較小的偶極矩。
自然界的存在形式
生產
丙烯是以礦物燃料——石油、天然氣和煤作為原料進行生產的。 丙烯是煉油和天然氣處理的副產物。在煉油工業中,乙烯、丙烯和其它化合物是通過更大的碳氫化合物裂化的方式生產的。丙烯也可以通過對裂化和其它精煉過程得到的產物進行分餾得到。[3]
專門針對丙烯的生產方式有如下幾個:
用途
- 註) 合成方式皆為對丙烯進行反應,依層次差別為進一步進行反應後的產物並在「-」符號後表示用途。
參見
- 1978年西班牙聖卡羅迪拉丙烯槽車爆炸事故
- 南京「7·28」爆炸事故
- 2014年8月1日臺灣高雄氣爆事故,疑丙烯造成。[6]
註釋
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.