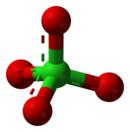
過氯酸鹽是過氯酸形成的鹽類,含有四面體型的過氯酸根離子—,其中氯的氧化態為+7。過氯酸鹽存在於自然界中,主要用作火箭燃料和煙火中的氧化劑和安全氣囊中的爆炸物。多數過氯酸鹽可溶於水。[2]
| 過氯酸鹽 | |||
|---|---|---|---|

| |||
| |||
| 系統名 Perchlorate[1] | |||
| 識別 | |||
| CAS號 | 14797-73-0 | ||
| PubChem | 123351 | ||
| ChemSpider | 109953 | ||
| SMILES |
| ||
| Gmelin | 2136 | ||
| ChEBI | 49706 | ||
| DrugBank | DB03138 | ||
| MeSH | 180053 | ||
| IUPHAR配體 | 4524 | ||
| 性質 | |||
| 化學式 | ClO− 4 | ||
| 摩爾質量 | 99.451 g mol−1 g·mol⁻¹ | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
常見的過氯酸鹽有:
氧化性
儘管其中氯的氧化態為+7,但在氯的所有含氧酸根離子中,過氯酸根離子在水溶液的氧化性最弱。[3]這是由於氯在過氯酸根離子中處於四面體的中心,不易發生反應。大多數過氯酸鹽,尤其是電正性金屬如鈉形成的化合物如過氯酸鈉,都相對較穩定,也因此可以取代曾經用於煙火中但具不穩定性的氯酸鹽類氧化劑。[來源請求]
在溶液中,Ru(II)可以將還原為,V(II)、V(III)、Mo(III)、二聚Mo(III)、Cr(II)和Ti(III)都可將還原為。[4]
溶解性
幾乎所有過氯酸鹽都可溶於水,且具有吸濕性或潮解性(銨鹽、鉀鹽、鉛鹽和亞汞鹽不潮解),過氯酸鉀難溶於乙醇(和過氯酸鈉不同)。[5]
參見
參考文獻
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.