近距離治療
来自维基百科,自由的百科全书
近距離治療(取自希臘語「brachys」一詞,意思是「短距離」),也稱作內照射放療、密封源式放射治療、鐳療法或內部鐳療法,是放射治療的一種形式,即將放射源放置於需要治療的部位內部或附近。近距離放射治療被廣泛應用於宮頸癌[1]、前列腺癌[2]、乳腺癌[3],食道癌[4]和皮膚癌[5],也同樣適用於許多其他部位的腫瘤治療。[6] 近距離放療可單獨進行或與其他療法,如外科手術、外照射放療和化療結合。
不同於外照射放療,即高能量的X射線從體外照射腫瘤。近距離放療是將放射源準確地放置於癌變腫瘤的區域。[6][7] 近距離放療最大的特點是:照射只影響到放射源周圍十分有限的區域。因而,可減小距離放射源較遠的正常組織受到的照射量。此外,在治療過程中,如果病人或體內的腫瘤發生移動,放射源因為事由機器控制,而且是再固定的管道中,所以能保持相對於腫瘤的正確位置。近距離治療的這些特色使其具備了外照射無法企及的多種優點——腫瘤可以接受局部高劑量治療,同時周圍的健康組織所獲得的不必要的損傷也大大降低。[6][7]
同其他放射治療技術相比,近距離治療的療程更短,有助於降低在每次治療間隙存活癌細胞分裂與生長的概率。[7] 與外照射治療相比,患者可以減少來院就醫的次數。治療通常是以門診的形式進行,為患者提供了更加直接、便捷的就醫方式。[8][9] 近距離治療的這些特點保證了大多數患者對近距離放療良好的耐受性。
近距離放療可有效治療多種類型的癌症。治療結果表明,近距離治療的治癒率與手術或外照射相近。當這些技術相結合時,治癒率更高。[10][11][12][13][14][15][16][17] 另外,近距離治療產生副作用的風險更低。[18][19]
歷史
近距離放射治療的歷史可以追溯到1901年(1896年貝克勒爾發現放射性元素不久)。當時皮埃爾·居里(Pierre Curie) 向亨利亞歷山大·當洛(Henri-Alexandre Danlos)提議可以將放射源植入腫瘤,[20][21] 放射源的照射可使腫瘤縮小。[21] 同一時期,亞歷山大·格雷厄姆·貝爾(Alexander Graham Bell)也提出了放射源的這一應用方式。[21] 在二十世紀初,巴黎居里研究所的當洛及紐約聖路加紀念醫院的羅伯特·阿貝(Robert Abbe)率先開始應用近距離治療技術。[6][21]
近距離治療興起之初,在歐洲及美國產生不小的反響。但到二十世紀中葉,由於放射源的手工操作會對操作者造成有害的照射,[21][22]近距離治療的利用率逐漸下滑。
然而,隨着遠程後裝系統的發展,治療時放射源從一個帶屏蔽的儲源罐中進出。以及在20世紀50年代和60年代新放射源的應用,使得操作者及患者接收有害照射的風險大大降低。[20] 隨着三維成像技術、計算機化的治療計劃系統和治療設備的最新進展,近距離治療成為一種安全、有效的治療方式,可適用於多種癌症類型。[6]
類型
界定不同類型的近距離治療,可依據:
- 治療靶區放射源的放置方式
- 腫瘤接受到的劑量率或「強度」
- 劑量照射的持續時間
根據放射源的放置方式,近距離治療可分為兩大類型:組織間插植式和接觸式。
近距離治療的劑量率指的是放射源對周圍媒介的照射劑量的水平或「強度」,並以戈瑞每小時(Gy/h)來表示。
- 中劑量率(MDR)近距離放療的特點是應用中等劑量率的放射源進行治療,劑量率範圍為2 Gy/hr至12 Gy/hr。[24]
放射源在靶區的放置方式,分為短期和永久。
臨床應用
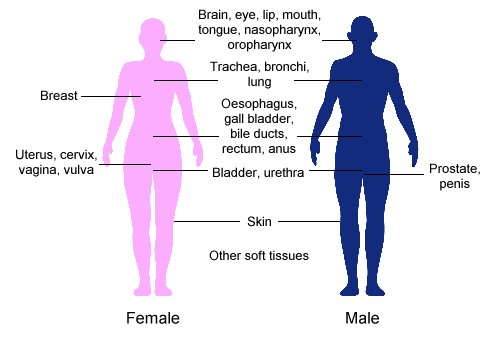
近距離治療常用於治療癌症的身體部位:宮頸[1]、前列腺[2]、乳腺[3],食道[4]與皮膚[5]。
近距離治療還可用於治療以下部位的癌症: 腦,[33]、眼[34]、頭頸(唇、口底、舌、鼻咽及口咽)[25]、呼吸道(氣管與支氣管)、[29] 消化道(食道、膽囊、膽管、直腸、肛門)[28][35][36][37]、泌尿道(膀胱、尿道、陰莖)[38][39][40]、女性生殖器官(子宮、陰道、陰戶)[41][42]和軟組織。[26]
由於放射源可以被精確地放置於腫瘤治療的部位,近距離治療可實現局部高劑量放療。此外,由於放射源可以被準確地放置於腫瘤靶區中或臨近位置,在患者移動或體內腫瘤運動時,放射源與腫瘤的相對位置可保持不變。因此,放射源可以在靶區內保持準備的定位。這一特點使得臨床醫師可以獲得很高的劑量適形度——保證整個腫瘤獲得最佳的照射劑量,同時減少腫瘤周圍健康組織、器官和結構的損傷的風險,[30] 進而提高治癒和保留器官功能的可能性。
相對於外照射放療,使用高劑量率近距離治療可縮短整個治療時間。[43][44] 一般情況下,接受近距離治療的患者相對於外照射治療到醫院就醫的次數更少,可在更短的時間完成整個放療過程。[45] 許多近距離治療都是以門診的方式進行,這為需要上班、老年患者、或居住在距治療中心較遠的患者提供了便利,保證了他們有條件接受治療並完成治療計劃。同時,更短的治療時間及門診就醫的方式也提高了放療科室的效率。[46][47]
對於腫瘤較小或局部晚期腫瘤、腫瘤沒有轉移(沒有擴散至其他的身體部位)的病人,近距離治療可達到治癒癌症的目的。對於適當選擇的病例,近距離治療原發性腫瘤與手術治療的方式所達到的療效近似,可獲得相同的治癒率,所產生的副作用也類似。[48][49] 但是,對於局部晚期腫瘤,手術通常難以取得很好的治癒率,有時候技術上也難以實施。對於這些病例,包括近距離治療在內的放射治療是唯一有可能治癒腫瘤的方式。[50][51] 對於更加晚期的腫瘤,近距離治療可作為姑息療法,緩解疼痛及出血症狀。
對於腫瘤的位置不容易接觸到或腫瘤體積過大,很難達到對治療區域進行理想照射的病例,近距離治療可與其他治療方式相結合,如外照射放療和/或手術。[6] 近距離治療單獨結合化療的治療方式是很少用到的。[52]
近距離放療常用於治療早期或局部受控的宮頸癌,在許多國家是一種標準的治療方式。[1][53][54][55][56] 子宮頸癌可接受低劑量率、脈衝式或高劑量率近距離治療。[12][55][57] 近距離治療與外照射結合,比單獨接受外照射放療的效果更好。[10] 近距離治療的精確性使得子宮頸可獲得高劑量的靶向照射,同時最大程度降低對於鄰近組織及器官的照射。[54][55][58][59]
低劑量率,脈衝式劑量率及高劑量率治療的無病生存率和帶病生存是相似的。[51][60] 但是,高劑量率治療的最大優勢在於可以門診形式進行治療,[10]治療時間短, 為許多患者提供了便利。
近距離放療治療前列腺癌症可以有兩種方式:永久性低劑量率粒子植入,或短時性高劑量率近距離治療。[2][61][62]
永久性粒子植入適用於局部腫瘤及預後良好的患者, [13][61][63][64]對於預防癌症復發,是一種行之有效的治療方式。[11][13]生存率與外照射或手術(根除式前列腺切除術)類似,但陽痿或大小便失禁等副作用更低。[19]治療可以很快完成,患者一般在治療的當天就可回家,1-2天後即可回歸正常生活。[8] 與手術切除前列腺相比,永久性粒子植入是一種危害性更小的治療手段。[8]
短時性高劑量率近距離治療是治療前列腺癌的一種新方式,目前還不如粒子植入常見。它更多的用於為外照射提供劑量補充(也稱作「推量」治療),因為它提供了另外一種方式,既可使前列腺內的腫瘤獲得適形的高劑量,又避免鄰近組織接受不必要的照射。[14][15][16][62][63][65] 高劑量率近距離治療用於前列腺癌的推量治療,意味着外照射治療的療程要比單獨外照射更短。[14][15][50][65]
由於食道癌患者發現時多已為中晚期,存活率低[66],近距離放療可提高放射劑量,及局部復發控制的能力,精準的將劑量傳送到食道腫瘤區域[67],一般分為治療性治療[68][69][70]和緩和治療[71][72][73]。治療性治療主要針對早期食道癌[68],或是在接受體外照射放療後,對殘餘的腫瘤再進行近距離放射,可避免附近組織接受不必要的劑量[69][70]。緩和性治療則可減緩食道狹窄而造成吞嚥困難、疼痛的問題,並能提升對局部復發的控制,可改善患者生存率[71][72]。
食道癌近距離放療過程,須採用適當的置放器或導管裝置,目前有加粗直徑的導管[74][68][75]或是於導管上新增一可膨脹裝置[76][77],因食道組織富含肌肉,具有強烈的收縮能力,置放器或導管可有效擴張食道,使放射源在管腔內不會接觸到食道壁[74][75][78][76]。醫生在進行近距離治療時,會將置放器或導管放入患者食道部位,並用影像確定腫瘤位置,再連接後荷式治療機,將適當的計量傳送到治療區域。
近距離治療是一種有效的治療方式,治療時間短,降低副作用,造福許多食道癌患者。
對於接受過乳房腫瘤切除術或是乳房切除術的女性,放射治療是一種標準的治療方式,是保乳治療不可缺少的一部分。[3][79] 近距離治療可用於手術後,化療前,或對晚期癌症進行姑息治療。[80]近距離放療治療乳腺癌常以高劑量率短時性的治療方式進行。術後,乳腺近距離治療可作為一種補量治療方式,在全乳外照射之後進行。[79][81] 近期,在APBI(加速部分乳腺照射)技術中,開始應用單獨的近距離治療,僅將劑量輸送到腫瘤原發位置的周圍。[17][79][81]
相比於外照射放療,乳腺近距離治療的主要優勢在於可以準確的高劑量照射腫瘤,同時避開健康的乳腺組織及其下部的結構,如肋骨和肺部。[80] APBI一般可在一周時間內完成整個療程。[17]近距離治療相對於外照射來說,治療時間更短(外照射需要患者1-2月的治療時間,頻繁到醫院就醫)。近距離治療這一優勢,對於需要工作的女性、年老或居住地距離治療中心較遠的女性至關重要,使其也可以從保乳治療獲益。[9]治療結束後隨訪的6年時間,乳腺癌近距離治療已經被證實具有良好的局部控制率。[17][82][83]一項針對APBI與外照射的治療後10年期醫療成效對比的研究正在進行中。 [84]
乳腺癌近距離治療分為兩種方式:
- 乳腺癌組織間插植近距離治療應用多根插植導管
- 乳腺癌腔內近距離治療應用球囊導管
乳腺癌組織間插植近距離治療是將多根柔性塑料導管置於乳腺組織,並短時間停留。通過精確的定位,以獲得對治療區域的優化照射,同時避開臨近的乳腺組織。[9]導管與後裝機連接,將制定的照射劑量傳輸到治療區域。乳腺癌組織間插植近距離治療可用於外照射治療後的補量,或作為APBI的治療方式。[81]
乳腺癌腔內近距離治療(也稱作「球囊式近距離治療」)是將單獨的導管放置於腫瘤切除後 (乳房腫瘤切除術)留下的空腔內。[9] 導管可在術中或術後插入。[9] 通過導管,空腔內的球囊被充滿氣。於是導管與後裝機相連, 將照射劑量通過導管傳輸到球囊中。當前,乳腺癌腔內近距離治療僅作為APBI的一種常規治療方式。[85]
除此之外,還有一些乳腺癌近距離治療裝置,將組織間和腔內治療的特點相結合(如:SAVI)。這些裝置具有多根治療導管,但僅通過單一入口進入乳腺,研究表明應用多根導管有利於醫生更精確的照射靶區。[86][87]
高劑量率近距離治療對於非黑素瘤的皮膚癌,如基底細胞癌和鱗狀細胞癌,提供了手術治療以外的另一種治療方式。尤其適用於鼻、耳、眼瞼或唇等,進行手術會導致毀容或需要大面積重建的部位。[5]可藉助多種施源器,保證放射源與皮膚的近距離接觸,與皮膚的曲面適形,並可有助於優化照射劑量的精確傳輸。[5]
皮膚癌近距離治療具有良好的美容效果及臨床效能; 隨訪5年的研究顯示近距離治療對於局部控制十分有效,與外照射治療效果相似。[88][89][90]治療時間一般較短,為患者提供便利。[91] 在未來,近距離治療很有可能成為皮膚癌的標準化治療方式。[91]
近距離放療可用於冠狀動脈支架再狹窄的治療,放射源通過置於血管內的傳輸導管進出。[92] 目前,醫師正在嘗試利用這種療法治療外部脈管狹窄 [93]或心房顫動。[94]
副作用
因近距離治療引起的急性、次急性或長期的副作用,其發生概率與腫瘤的位置及近距離治療的類型有關。
近距離治療引發的急性副作用包括局部淤血,腫脹,流血,插植部位流膿或不適。這些症狀通常在治療完成的幾天之內就會緩解。[95] 患者可能在治療後短期內感到身體疲憊。[95][96]
近距離治療宮頸癌或前列腺癌可導致急性或暫時性尿路症狀,如排尿困難、大小便失禁或排尿疼痛(尿痛)。[19][97][98] 也可能發生短暫性腸道運動增加、腹瀉、便秘或直腸少量出血。[19][97][98]急性和次急性副作用通常在幾天或幾周內緩解。對於前列腺癌永久性粒子植入近距離治療,也有少量病例,可能出現一些粒子從治療區域轉移到膀胱或尿道,通過尿液排出。
在治療結束的幾周內,近距離治療皮膚癌可能會引起治療區域周圍皮膚表層脫落(脫離),這種情況通常可在5-8周內康復。[5]如果癌症位於唇部,可能會引起潰瘍,但通常4-6周後就可緩解。[99]
近距離治療引發的急性副作用,大多數情況可通過藥物或改變飲食進行調整,治療完成後很快消失(通常是幾周)。高劑量率近距離治療的急性副作用大體上與外照射類似。[96]
對於少部分人群,近距離治療可能會因臨近組織或器官的損傷導致長期的副作用。長期副作用通常是輕微、適度的。例如:宮頸癌或前列腺癌的近距離治療可能會導致泌尿或消化道的問題,可能需要長期的調理。[19][97][98]
前列腺癌的近距離治療可能會導致勃起功能障礙,發生的概率約為15-30%。[2][32]但是,發生此副作用的風險與患者的年齡(老年患者比年輕患者的風險更大)及治療前勃起功能的水平都有關係。對於確實有勃起功能障礙的患者,大部分患者可以通過藥物治療,如偉哥。[2]重要的是,相比根治性前列腺切除術,近距離治療導致勃起功能障礙的風險要低。[48][97]
乳腺癌或皮膚癌的近距離治療可能會引起治療區域附近產生疤痕組織。乳腺癌的近距離治療病例中,由於脂肪酸進入乳腺組織可能會導致脂肪壞死,從而使得乳房組織腫脹和變軟。乳腺脂肪壞死屬於良性症狀,一般會在治療後的4-12個月出現,大概會影響2%的患者。[100][101]
周圍的安全
患者經常會詢問在接受近距離治療後,對於周圍的家人和朋友,他們是否需要特殊的安全防範措施。如果是短期近距離放療,治療結束後,沒有放射源存留在體內。因此對於周圍親近的朋友或家人是沒有放射性危險的。[102]
如果是永久性近距離治療,低劑量放射源(粒子)在治療後仍然停留在人體內-輻射水平很低,並且隨着時間減小。此外,輻射只會影響放射源(接受治療的腫瘤)附近幾毫米的組織。為了安全起見,部分接受永久性近距離治療的患者會被告知在治療後的短期內,不要近距離接觸小孩或懷孕婦女。放療醫生或護士會告知患者需要注意的事項,以及需要注意多長時間。[102]
治療流程

為保證準確的計劃近距離治療流程,了解腫瘤的性質,需要進行全面的臨床檢查。除此之外,還需要藉助一些成像設備查看腫瘤的形狀和大小,及其相對於臨近組織及器官的位置關係。這些成像設備包括:X光機、超聲、計算機斷層掃描(CT或CAT)及核磁共振成像(MRI)。[103]獲得的影像可用於腫瘤及臨近組織的三維模擬成像。[103]
藉助這些信息,可確定優化的放射源分布,其中包括放射源的載體——施源器(用於將放射源輸送到治療部位)的放置方式和位置。[103]施源器不具有放射性,常見的是插植針或塑料導管。依據治療癌症的種類和靶區腫瘤的性質,選擇合適的施源器類型 。[103]
初始計劃可以避免治療中出現 「冷點」(過低輻射)及「熱點」(過高輻射),他們分別會影響治療失敗及副作用。[58]
在放射源輸送到腫瘤部位之前,施源器必須按照初始計劃,插入體內並正確定位。
多種成像技術,如X射線、熒光透視和超聲,常用於引導施源器的正確定位,及進一步優化治療計劃。[103]也可使用CAT掃描及核磁成像MRI。[103]施源器置入體內後,通過縫合線或膠布將其固定在皮膚上,防止移動。確認施源器處於正確位置後,可進行進一步成像,制定具體的治療計劃。[103]

包含施源器的病人圖像導入治療計劃系統後,患者被轉移到專用的帶屏蔽的治療機房。治療計劃系統可將多張治療部位的二維圖像轉化成三維「虛擬病人」圖像,由此可以確定施源器的位置。[103]在「虛擬病人」圖像上的施源器、治療部位及周圍健康組織三者的空間位置關係,與真實患者體內的關係是一致的。

治療計劃系統可以將虛擬放射源放置在虛擬病人的體內,進而確定組織間或腔內施源器內的放射源在時間與空間上的最優分布。軟件可以用圖形表示出輻射的分布。引導放射治療醫師們進一步優化放射源分布,從而保證在實際劑量傳輸前,治療計劃與每位患者的解剖結構相適應。[104]這種方法有時被稱作「劑量圖」。
近距離治療所用的放射源通常密封在一個非放射性的球囊中。放射源可以手動輸送,但更常見的是通過一種技術來輸送,被稱作「後裝」。
由於對臨床醫生有輻射風險,手動實施近距離治療僅限於一些低劑量的應用。[31]
與之相反,後裝包括將非放射性施源器精確放置於治療部分,然後再裝入放射源。在手動後裝治療中,由操作人員將放射源輸送到施源器中。
遠程後裝治療系統可以將放射源安放在帶屏蔽的保險罐中,為後裝操作人員提供輻射防護。施源器在病人體內正確定位後,通過一系列的連接導管與後裝機(載有放射源)連接。後裝機按照導入的治療計劃, 控制放射源通過連接導管到達施源器內預先設定的位置。這一過程完全是在治療醫師遠離機房時完成的。依據治療計劃,放射源駐留相應的時長,之後通過套管返回後裝機內。
在放射源治療結束後,小心地將施源器移出體內。一般情況下,近距離治療結束後,患者會很快恢復,近距離治療通常以門診的形式進行。[30]
放射源
近距離治療常用的放射源(放射性核素):
電子近距離治療
電子近距離治療使用小型低能量X射線管源,將其放置於身體或腫瘤腔內預先定位好的施源器中,實現快速靶區組織高劑量治療,同時保持對遠端非靶區組織的低劑量。[106]
擴展閱讀
- 外照射放射治療(External beam radiotherapy)
- 前列腺近距離治療(Prostate brachytherapy)
- 靶向術中放療(TARGIT)
參考文獻
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.