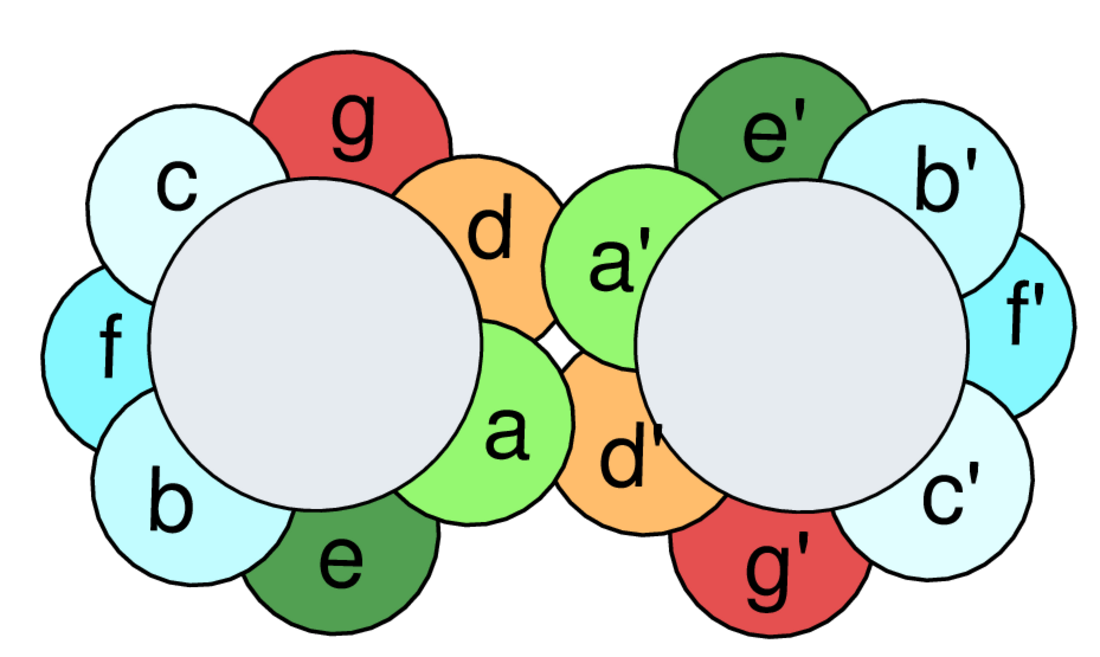
亮氨酸拉鏈(英語:leucine zipper,亦稱為亮氨酸剪刀[1])是蛋白質中一種常見的三維結構模體,常見於許多轉錄因子的DNA結合結構域,因此涉及基因的表達調控。亮氨酸拉鏈在真核生物和原核生物的蛋白中都有發現,但以真核生物居多。
亮氨酸拉鏈是一種作為二聚體化結構域的超二級結構,且使相互平行的α-螺旋之間產生粘附力[2]。一個亮氨酸拉鏈包含了多個亮氨酸殘基,通常每七個氨基酸殘基就出現一次,這形成了一條兩性的α-螺旋,疏水區只在其中一側。這個疏水區提供了二聚化的區域,使得基序可以像「拉鏈」一樣拉起來。此外,疏水亮氨酸區域對於其結合到DNA是不可或缺的。
結構

亮氨酸拉鏈結構域的主要特徵是七肽重複的d位上大部分都是常見氨基酸——亮氨酸。通過對特定的一些轉錄因子的序列比對,發現這些轉錄因子形式都是每七個氨基酸出現一個亮氨酸,於是亮氨酸拉鏈首次鑑定出來。後來發現這些亮氨酸形成了捲曲螺旋的疏水核心。
亮氨酸拉鏈的每一半都是由每七個位置一個亮氨酸的短α-螺旋組成。標準的每一轉3.6個殘基的α-螺旋結構在亮氨酸拉鏈中發生了輕微的變化,形成了每一轉3.5個殘基的α-螺旋。與七肽重複一樣,每條鏈每兩轉就有一個亮氨酸與另一條鏈上的亮氨酸發生接觸。
轉錄因子中的bZIP家族由兩個區域組成,其中之一是通過氫鍵與DNA的小溝發生作用的鹼性區域,另一區域是承擔二聚化作用的疏水性的亮氨酸拉鏈。
生物學
亮氨酸拉鏈調節蛋白包括c-fos與c-jun(AP1轉錄因子),還有myc家族的成員包括myc、max與mdx1,它們是正常發育的重要調控物。如果它們在一些部位發生過量表達或突變,則會產生癌症。這些蛋白質以二聚體(同二聚體或異二聚體)的形式與DNA發生相互作用,又被稱為鹼性拉鏈蛋白(bZips)。
參考文獻
外部連結
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.