銨
NH₄⁺ 来自维基百科,自由的百科全书
| 銨 | |||
|---|---|---|---|

| |||
| |||
| 系統名 Ammonium | |||
| 識別 | |||
| CAS號 | 14798-03-9 | ||
| PubChem | 16741146 | ||
| ChemSpider | 218 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | QGZKDVFQNNGYKY-IKLDFBCSAZ | ||
| ChEBI | CHEBI:28938 | ||
| MeSH | D000644 | ||
| 性質 | |||
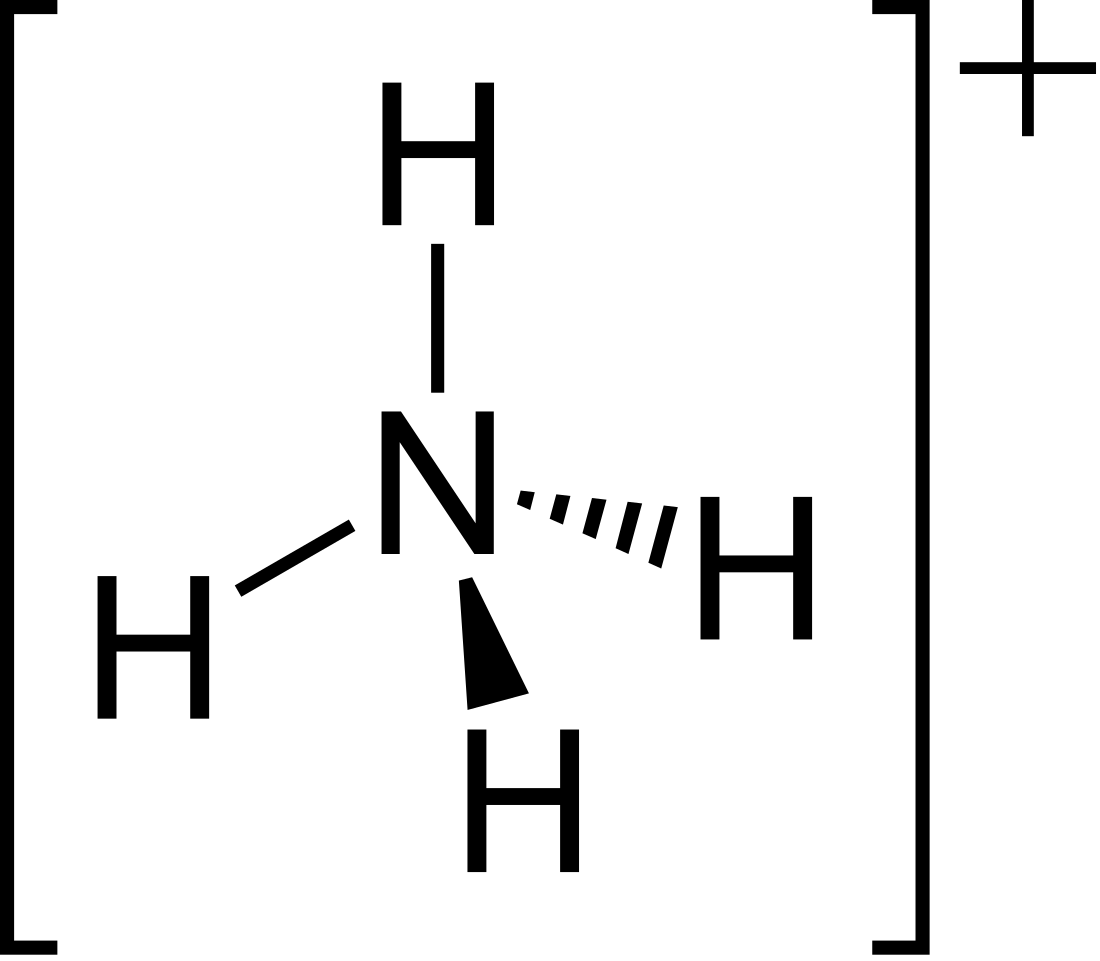
| 化學式 | NH+ 4 | ||
| 摩爾質量 | 18.04 g·mol⁻¹ | ||
| pKa | 9.25 | ||
| 結構 | |||
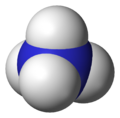
| 分子構型 | 正四面體 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||

結構
存在

酸性環境下,溶解在水中的氨分子以銨根離子的形式存在。氨水可電離出銨根離子和氫氧根離子,濃氨水容易揮發為氨氣。液氨自耦電離能產生銨離子。
命名
由於NH4+的化學性質類似於金屬離子,故命名為金部的「銨」。
「銨」的普通話拼音為「ǎn」,區別於陰平(第1聲)的「氨」和去聲(第4聲)的「胺」。但在台灣,「銨」和「氨」讀音均為「ㄢ」。
用途
檢驗
銨鹽的檢驗方法通常是與鹼混合併加熱[註 1],會產生能使濕潤紅色石蕊試紙變藍的氣體(氨氣)。例如:
原理是銨鹽與鹼發生複分解反應,生成新鹽和氨水,氨水易揮發為氨氣和水。
- 銨鹽可以與奈斯勒試劑反應生成黃棕色沉澱,用於定性檢驗。
要區別碳酸氫銨於其他的銨鹽,可以通過加熱的方式。[來源請求]
但請注意:這個方法不應在銨鹽可能是硝酸銨的情況下使用,因為硝酸銨遇高溫容易發生爆炸。
衍生物
銨金屬
在高壓下,浸在大量自由電子海中的銨離子可能會表現出類似於金屬的性質。冰巨星天王星與海王星的內部就可能存在這種「銨金屬」。[1][2]
註解
注釋
參見
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


![{\displaystyle {\ce {{NH4}^{+}+ 2{[HgI4]}^{2-}+ 4OH- -> HgO*Hg(NH2)I + 7I- + 3H2O}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/ec2cdfdb9af44bdf5e577d90e7a03b53eaac2c4c)
![{\displaystyle {\ce {=[{\text{△}}]}}}](http://wikimedia.org/api/rest_v1/media/math/render/svg/0478caeebea240591c5974d34cc8fcdb82b0a60b)