蛋白酶
来自维基百科,自由的百科全书
蛋白酶(protease,proteinase)又稱肽酶(peptidase)、蛋白水解酶(proteolytic enzyme)或蛋白質分解酶[1],是生物體內一類催化蛋白質或肽類中肽鍵水解的酶(酵素),可將蛋白質分解成較小的多肽或單一氨基酸,並促進新蛋白質產物的形成[2]。
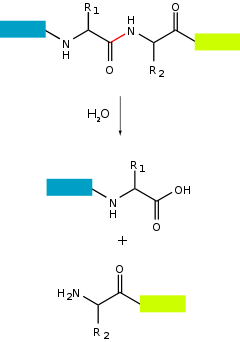
儘管國際生物化學和分子生物學聯盟命名委員會認為蛋白酶與肽酶為同義詞[3],仍有些學者定義兩者不同,例如:蛋白酶是內肽酶[4],或是認為「蛋白酶」為能夠水解蛋白質分子內部的肽鍵,而「肽酶」只能從肽類末端的水解,每次水解釋放一個氨基酸,其又分為:氨肽酶,羧肽酶[5]。
蛋白酶參與多種生物途徑,包括消化攝取的蛋白質、蛋白質分解(舊蛋白質的分解)[6][7]和細胞信號傳送。
如果沒有功能性加速劑,蛋白水解過程將非常緩慢,需要數百年的時間。[8]蛋白酶存在於所有形式的生命和病毒中。它們已經獨立進化了多次,不同種類的蛋白酶可以透過完全不同的催化機製完成相同的反應。
分類
目前已知的蛋白酶可以分成以下7大類[9]:
- 絲氨酸蛋白酶(Serine proteases) - 使用絲氨酸醇
- 蘇氨酸蛋白酶(Threonine proteases)- 使用蘇胺酸仲醇
- 半胱氨酸蛋白酶(Cysteine proteases) - 使用半胱氨酸硫醇
- 天冬氨酸蛋白酶(Aspartic acid proteases)- 使用天冬氨酸羧酸
- 金屬蛋白酶(Metalloproteases) - 使用金屬,通常是鋅[6][7]
- 穀氨酸蛋白酶(Glutamic acid proteases)- 使用穀氨酸羧酸
- 天門冬酰胺肽裂解酶(Asparagine peptide lyase) - 使用天門冬酰胺進行消除反應(不需要水)
1993年,蛋白酶首次依其演化關係分為84個家族,並分為四種催化類型:絲氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶和金屬蛋白酶。[10]蘇氨酸蛋白酶和穀氨酸蛋白酶分別直到 1995 年和 2004 年才被描述。用於裂解肽鍵的機制涉及使具有半胱氨酸和蘇氨酸(蛋白酶)或水分子(天冬氨酸、穀氨酸和金屬蛋白酶)的氨基酸殘基具有親核性,以便它可以攻擊肽羰基。 製備親核體的一種方法是透過催化三聯體,其中組胺酸殘基用於活化絲胺酸、半胱氨酸或蘇胺酸作為親核體。然而,這不是一個進化分組,因為親核體類型在不同的蛋白質超家族中趨同進化,並且一些蛋白質超家族表現出向多種不同親核體的發散進化。金屬蛋白酶、天門冬胺酸蛋白酶和穀氨酸蛋白酶利用其活性位點殘基活化水分子,然後攻擊易裂鍵。[11]
酶的功能和機制

蛋白酶透過分裂連接胺基酸殘基的肽鍵,將長蛋白質鏈消化成較短的片段。有些將末端胺基酸從蛋白鏈上分離(外肽酶,例如氨肽酶、羧肽酶A);其他攻擊蛋白質的內部肽鍵(內肽酶,例如胰蛋白酶、胰凝乳蛋白酶、胃蛋白酶、木瓜蛋白酶、彈性蛋白酶)。
催化是透過以下兩種機制之一來實現的:
蛋白質水解可以是高度混雜的的,使得多種蛋白質底物被水解。消化酶例如胰蛋白酶等就是這種情況,它必須能夠將攝取的一系列蛋白質裂解成更小的肽片段。混雜的蛋白酶通常與底物上的單一氨基酸結合,因此僅對該殘基具有特異性。例如,胰蛋白酶對序列 ...K\... 或 ...R\... 具有特異性(「\」=切割位點)。[12]
相反,一些蛋白酶具有高度特異性,僅切割具有特定序列的底物。血液凝固(例如凝血酶)和病毒多蛋白加工(例如TEV蛋白酶)需要這種程度的特異性才能實現精確的切割事件。這是透過具有長結合裂縫或隧道的蛋白酶來實現的,該裂縫或隧道具有多個結合特定殘基的口袋。例如,TEV蛋白酶對序列...ENLYFQ\S...(「\」=切割位點)具有特異性。[13]
蛋白酶本身就是蛋白質,可以被其他蛋白酶分子(有時是同一種類的)切割。這是調節蛋白酶活性的一種方法。有些蛋白酶在自溶後活性較低(例如TEV蛋白酶),而有些則活性較高(例如胰蛋白酶原)。
蛋白酶的生物多樣性
蛋白酶存在於所有生物體中,從原核生物到真核生物到病毒。這些酶參與多種生理反應,從食物蛋白質的簡單消化到高度調節的級聯反應(例如凝血級聯反應、補體系統、細胞凋亡途徑和無脊椎動物酚氧化酶原激活級聯反應)。蛋白酶可以破壞特定的肽鍵(有限的蛋白質分解),這取決於蛋白質的氨基酸序列,也可以將肽完全分解為氨基酸(無限的蛋白質分解)。此活性可以是破壞性變化(消除蛋白質的功能或將其消化為其主要成分),可以是功能的激活,也可以是訊號傳導途徑中的訊號。
用途
蛋白酶研究領域十分龐大。自 2004 年以來,每年約有 8,000 篇與該領域相關的論文發表[14]。蛋白酶被用於工業的、醫學的和基礎生物學的研究工具[15][16]。
消化蛋白酶是許多洗衣粉的一部分,也廣泛用於麵包工業的麵包改良劑。 蛋白酶是重要的工業酶,佔全球總酶銷售量約六成,其中七成用於工業用途的蛋白酶用於食品發酵等方面[17],例如酸性蛋白酶用於傳統發酵食品和調味品的生產[18][19]及催化酪蛋白沈澱;中性蛋白酶因能夠去除水解產物的苦味而令醬油脫苦[20];鹼性蛋白酶應用於食品烘烤等方面[21],因為能夠有效提高生麵團的延性和韌性,並且增強麵包的起泡性。
抑制劑
蛋白酶的活性受到蛋白酶抑制劑的抑制。蛋白酶抑制劑的一個例子是絲氨酸蛋白酶抑制劑蛋白質超家族。它包括α1-抗胰蛋白酶(可保護身體免受自身發炎蛋白酶的過度影響)、α1-抗胰凝乳蛋白酶(具有相同的作用)、C1 抑制劑(可保護身體免受蛋白酶觸發的自身補體系統過度活化 )、抗凝血酶(保護身體免於過度凝血)、纖溶酶原激活劑抑制劑-1(透過阻斷蛋白酶觸發的纖溶作用,保護身體免於凝血不足)和神經絲氨酸蛋白酶抑制劑。[22]
天然蛋白酶抑制劑包括脂質運載蛋白家族,在細胞調節和分化中發揮作用。已發現與脂質運載蛋白相連的親脂性配體具有腫瘤蛋白酶抑制特性。天然蛋白酶抑制劑不應與抗逆轉錄病毒治療中使用的蛋白酶抑制劑混淆。一些病毒,其中包括愛滋病,在其繁殖週期中依賴蛋白酶。因此,蛋白酶抑制劑被開發為抗病毒治療劑。
其他天然蛋白酶抑制劑被用作防禦機制。常見的例子是在一些植物的種子中發現的胰蛋白酶抑制劑,對人類來說最引人注目的是大豆,一種主要的糧食作物,它們的作用是阻止掠食者。生大豆對包括人類在內的許多動物有毒的,直到它們所含的蛋白酶抑制劑變性為止。
參見
參考文獻
外部鏈接
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
