血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura,TTP) 是一种弥散性血栓性微血管病,以微血管病性溶血性贫血、血小板聚集消耗性减少,以及微血栓形成造成器官、系统损害为特征。
| 血栓性血小板减少性紫癜 | |
|---|---|
| 同义词 | Moschcowitz症; 自发性血小板缺乏紫斑症(Idiopathic Thrombocytopenic. Purpura,ITP)[1] |
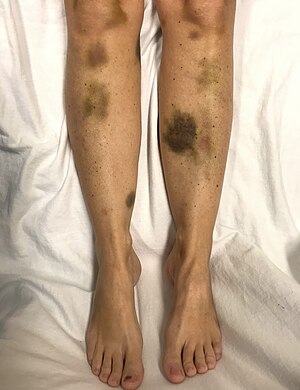 | |
| 血小板严重偏低的女性出现自发性瘀伤 | |
| 类型 | 高凝固性血液[*]、血小板减少性紫癜、rare thrombotic disorder due to a platelet anomaly[*]、thrombotic microangiopathy[*]、疾病 |
| 分类和外部资源 | |
| 医学专科 | 血液学 |
| ICD-11 | 3B64.14 |
| OMIM | 274150 |
| DiseasesDB | 13052 |
| MedlinePlus | 000552 |
| eMedicine | 206598 |
| Orphanet | 54057 |
TTP属于一种微血管血栓出血综合征(thrombotic hemorrhagic syndrome),少见且严重,会导致全身小血管中形成血栓[1],血小板计数低、红细胞因分解而计数低,且常导致肾脏、心脏、大脑功能障碍[2]。症状包括瘀斑、发烧、虚弱、呼吸困难、神志不清和头痛等[1],且可能反复发作[3]。
约一半的TTP病例可以确定诱因,而其余则仍未可知[3]。已知诱因包括细菌感染、某些药物影响、狼疮等自身免疫性疾病、怀孕等[3]。潜在的机制通常牵涉到抑制ADAMTS13酶的抗体[2],导致类血友病因子(von Willebrand factor,vWF)的低聚物分解次数减少[2]。一些罕见TTP来自遗传,称为Upshaw-Schulman综合征,其患者ADAMTS13功能障碍从出生起就存在[4]。诊断通常基于症状和血液检查,并通过测试ADAMTS13活性或抗体进一步确认[1]。
通过血浆置换,TTP死亡风险可从高于90%降至低于20%[2]。也可以使用例如糖皮质激素和利妥昔单抗等免疫抑制剂[3],但是一般不建议血小板输注[5]。
大约每10万人中有1人患病[3]。TTP年发病率为每百万人2-6人,女性与男性之比约2∶1,发病通常在成年期,年龄30-50岁[3],但大约10%的病例始于童年[3]。1924年Eli Moschcowitz首次描述了这种情况[3]。其根本机制是在20世纪80到90年代确定[3]。
体征和症状
TTP 的体征和症状起初可能是微妙且非特异性的。许多人患TTP前都经历过类似流感或腹泻的疾病[6]。神经系统症状非常常见,并且严重程度差异很大。经常报告的症状包括疲劳、意识混乱和头痛[6],还包括癫痫等症状[6]。其他症状包括但不限于黄疸、皮肤苍白、心率加快或呼吸急促[7]、皮肤出现瘀点[8]。高血压也有被观察到[9]。
随TTP发展,微血管系统内形成血栓,并且血小板(凝血细胞)会被消耗。结果可能出现瘀伤,但很少有出血。瘀伤通常表现为紫癜,而最常见的出血部位(如果发生)是在鼻子或牙龈。也可能出现较大的瘀伤(瘀斑)[10]。TTP的典型表现包括五种医学症状,发生率不到10%,包括[3]:
原因
TTP与其他微血管病性溶血性贫血(microangiopathic hemolytic anemia,MAHA)一样,是由血小板自发聚集以及小血管内凝血激活引起的。血小板在聚集过程中被消耗并结合vWF 。这些血小板-vWF复合物形成小血栓,在血管中循环并引起红细胞剪切,导致其破裂并形成裂红细胞[11]。TTP两个最容易理解的成因是自身免疫(获得性TTP),由针对ADAMTS13 的自身抗体引起[12];或先天性TTP:ADAMTS13 的遗传性缺陷(Upshaw-Schulman综合征)[11]。
1998年,大多数病例被证明是由抗体抑制ADAMTS13酶引起的。 两个独立的研究小组(Furlan 和 Tsai),同时在新英格兰医学杂志上发表了他们对ADAMTS13减少与TTP发病机制之间这种关系的研究成果[13]。
免疫性TTP(iTTP)因患者体内产生抗ADAMTS13自身抗体,抑制ADAMTS13活性或与ADAMTS13结合形成复合物而加速ADAMTS13的体内清除[14]。ADAMTS13是一种金属蛋白酶,负责分解vWF,vWF是一种在凝血过程中连接血小板、血栓和血管壁的蛋白质。非常大的vWF多聚体更容易导致凝血。因此,如果ADAMTS13没有正确裂解 vWF,凝血速率就会提高,尤其是在微脉管系统中,微脉管系统是血管系统的一部分,由于高剪切应力,vWF在此处最为活跃[4]。

TTP可能是先天性的,由ADAMTS13基因突变引起[17][18]。遗传性TTP(cTTP,又称为Upshaw-Schulman综合征),也拼写为Upshaw-Schülman[19][20]。cTTP系ADAMTS13基因突变可导致血浆ADAMTS13活性降低,常在感染、炎症或妊娠等促发因素下发病。cTTP呈常染色体为隐性遗传,基因突变表现为纯合子型或双重杂合子型[14]。患有这种遗传性ADAMTS13缺陷的人具有令人惊讶的温和表型,但在冯维勒布兰德因子水平升高(例如感染)的临床情况下会发展为TTP。据报道,所有TTP病例中不到5%是由Upshaw-Schulman综合征引起[21]。患有这种综合征的人的ADAMTS13活性通常只有正常的5-10%[22][23]。
当患者的病史提及与 TTP 相关的已知特征之一时,即可诊断继发性 TTP。它约占所有 TTP 病例的 40%。诱发因素有[11]:
继发性TTP的机制尚不清楚,因为ADAMTS13活性通常不像特发性TTP那样低,且也无法检测到抑制剂。可能的病因可能涉及(至少在某些情况下)内皮损伤[25] ,尽管导致血管闭塞的血栓形成在继发性TTP的发病机制中可能非必需[26]。这些因素也可被视为继发aHUS的一种形式;因此,具有这些特征的人是抗补体治疗的潜在候选者。
病理生理学
潜在TTP机制通常涉及自身抗体介导的ADAMTS13酶抑制,ADAMTS13是一种金属蛋白酶,负责将vWF的大多聚体切割成更小的单位。循环中vWF多聚体含量的提高增加了血小板对内皮损伤区域的粘附,特别是在小动脉和毛细血管相遇的地方,反过来又导致血栓的形成。[27]由于血小板在血栓形成中被耗尽,导致循环血小板总数减少,可能导致危及生命的出血。通过微小凝块的红细胞会受到剪切应力,损坏其细胞膜,导致血管内红细胞破裂,产生溶血,[8]进而导致微血管病性溶血性贫血和裂红细胞形成。血栓的存在减少了流向器官的血流量,导致细胞损伤和终末器官损伤。[12]
诊断
TTP在凝血检查中,活化部分凝血活酶时间(APTT)、凝血酶原时间(PT)及纤维蛋白原检测多正常,偶有纤维蛋白降解产物轻度升高。[14]
TTP是血栓性微血管病(thrombotic microangiopathy,TMA)的一种,[29]在全身小血管中形成血栓,可导致微血管病性溶血性贫血和血小板减少症。[29]两种相关综合征(溶血性尿毒症综合征(hemolytic-uremic syndrome,HUS)和非典型溶血性尿毒症综合征(atypical hemolytic uremic syndrome,aHUS)都具有这一特征。 [30]因此,这些 TMA 疾病的鉴别诊断至关重要。 TTP和HUS均以发热、贫血、血小板减少、肾功能衰竭和神经系统症状为特征。一般来说,TTP的神经系统症状发生率(≤80%)高于HUS(10-20%),肾脏症状发生率低于HUS(9%对90%)。 [31]
与HUS和aHUS不同,[32] [33] TTP已知是由 ADAMTS13 蛋白缺陷引起的,[34]因此实验室测试显示ADAMTS13水≤5%正常水平即表明存在TTP。[27]ADAMTS13水平高于5%,加上志贺毒素、肠出血性大肠杆菌(enterohemorrhagic E. coli ,EHEC)检测呈阳性,更可能表明患有HUS, [35]而没有志贺毒素、EHEC则可以确诊aHUS。 [27]
治疗
由于TTP如不能及时治疗死亡率高,即使仅出现微血管病性溶血性贫血和血小板减少症,也可推定为TTP,临床上在中度或高度怀疑本病时即应尽快开始相关治疗。[14]血栓性TTP患者禁止输血,因为会加剧凝血障碍。自20世纪90年代初以来,血浆置换已成为TTP的首选治疗方法。[36][37]这是一种交换输血,涉及通过单采术去除人的血浆并用供体血浆(新鲜冷冻血浆或冷冻上清液)替换;必须每天重复该过程以消除抑制剂并减轻症状。单独输注血浆不如血浆置换有益,如果无法进行单采,可以输注新鲜冷冻血浆,但由于存在液体超负荷的危险,安全输注量有限。血浆置换推荐每次2000-3000 ml或40-60 ml/kg,每日1-2次直至症状缓解、血小板计数恢复正常连续两天后可逐渐延长血浆置换间隔,直至停止。[14][38][36]给药一般酌情联合使用糖皮质激素(泼尼松或泼尼松龙)。 [37]利妥昔单抗是一种针对B淋巴细胞上CD20分子的单克隆抗体,可用于诊断;这被认为会杀死B细胞,从而减少抑制剂的产生。[37]如果TTP对皮质类固醇和血浆置换术没有反应,则强烈建议使用利妥昔单抗。[37]
卡普赛珠单抗是治疗TTP的另一种选择,它已被证明与服用安慰剂的患者相比,可以更快地缓解疾病。[39]卡普赛珠单抗可阻断vWF A1区与血小板糖蛋白GPIb结合作用,阻止相互作用,防止小动脉和毛细血管内微血栓形成、减少终末器官损害,在TTP发病早期使用最有益。[14]但卡普赛珠单抗并不能纠正ADAMTS13缺乏,也不能清除ADAMTS13自身抗体,在一些研究对象中,使用caplacizumab与出血倾向增加有关。[40]
难治性或复发性TTP患者可能会接受额外的免疫抑制治疗,例如长春新碱、环磷酰胺、环孢素A或脾切除术。[3]
患有Upshaw-Schulman综合征的儿童每两到三周接受一次预防性血浆治疗;这可以维持ADAMTS13足够功能的水平。有些可以耐受较长的血浆输注间隔。一些事件中可能需要额外的血浆输注,例如手术;或者,可以在这些事件前后密切监测血小板计数,如果计数下降则给予血浆。 [41]
乳酸脱氢酶、血小板和片红细胞血液水平的测量用于监测疾病进展。[12]可以在随访期间测量 ADAMTS13活性和抑制剂水平,但对于没有症状的患者,不建议使用利妥昔单抗。 [37]
预后
未经治疗的病例死亡率约为95%,但早期诊断并通过血浆置换治疗的特发性TTP患者的预后相当良好(80-90%的生存率)。[42]
流行病学
TTP的发病率约为每年每百万人4-5例。 [43]特发性TTP在女性和非洲人后裔中更常见,而继发于自身免疫性疾病(例如系统性红斑狼疮)的TTP在非洲人后裔中更常见,尽管其他继发性形式并未显示出这种分布。[44]尽管黑人患TTP的风险较高,但与其他种族相比,黑人的TTP表现并没有任何显着特征。[45]一些研究中,孕妇和产后妇女占病例的显着比例(12-31%);TTP影响约25,000例妊娠中的1例。[46]
TTP最初由Eli Moschcowitz于1924 年在纽约市贝斯以色列医院描述。[47][48]其将这种疾病(据目前所知是错误的)归因于中毒原因。Moschcowitz指出,患者是一名16岁女孩,患有贫血、瘀伤、镜下血尿,尸检时发现有播散性微血管血栓。[49]1966年,对16个新病例和255个先前报告的病例进行回顾,得出了经典的五联征症状和发现(即血小板减少症、微血管病性溶血性贫血、神经系统症状、肾衰竭、发热);在这个系列中,死亡率非常高(90%)。[50]
虽然之前已经注意到输血的反应,但1978年的一份报告和随后的研究表明血浆在改善疾病过程方面非常有效。[51]1991年,据报道血浆置换比血浆输注具有更好的缓解率。[52]1982年,这种疾病与异常大的类血友病因子多聚体有关。1998年鉴定出TTP患者存在蛋白酶缺陷。ADAMTS13 在人类基因组中的位置于2001年确定[51]
参考文献
外部链接
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
