依那西普(英语:Etanercept),目前有以Enbrel(恩博) 等商品名称销售,是种生物制药,有肿瘤坏死因子抑制剂作用,可干扰肿瘤坏死因子(TNF,一种可溶性促炎细胞因子,旧称肿瘤坏死因子-α(TNF-α))来治疗自体免疫性疾病,经美国食品药物管理局 (FDA) 批准用于治疗类风湿性关节炎、幼年特发性关节炎和干癣性关节炎、干癣和强直性脊柱炎。肿瘤坏死因子是造成许多器官系统发炎(免疫)反应的"主调节因子"。自体免疫性疾病是由个体本身过度活跃的免疫反应所引起。依那西普可透过抑制TNF而达到治疗的目的。[13]]
 | |
| 临床资料 | |
|---|---|
| 商品名 | Enbrel(恩博) |
| 生物相似药 | Etanercept-szzs, Etanercept-ykro, Benepali, Erelzi, Etacept, Etera,[1] Eticovo, Lifmior, Nepexto,[2] Rymti[3] |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a602013 |
| 核准状况 |
|
| 怀孕分级 | |
| 给药途径 | 皮下注射 |
| ATC码 | |
| 法律规范状态 | |
| 法律规范 | |
| 药物动力学数据 | |
| 生物利用度 | 58–76% (SC,口服生物利用率) |
| 生物半衰期 | 70–132小时 |
| 识别信息 | |
| CAS号 | 185243-69-0 |
| PubChem SID | |
| DrugBank | |
| ChemSpider |
|
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.224.383 |
| 化学信息 | |
| 化学式 | C2224H3475N621O698S36 |
| 摩尔质量 | 51,235.07 g·mol−1 |
依那西普是种由重组DNA产生的融合蛋白,将TNF受体融合到免疫球蛋白G1 (IgG1)抗体的恒定端。开发人员首先将编码人类可溶性TNF受体2(CD120)基因的DNA序列分离,CD120是一种可与肿瘤坏死因子结合的受体。他们接著分离出编码人类免疫球蛋白G1Fc端基因的DNA序列。第三个步骤是他们将TNF受体2的DNA与IgG1 Fc的DNA连接。他们最后表达(转录)连接的DNA,以产生一种蛋白质,此蛋白质可将TNF受体2的蛋白质与IgG1 Fc的蛋白质连接。[14]
这种原型融合蛋白是由在美国达拉斯德克萨斯大学西南医学中心担任学术研究员的布鲁斯·比尤特勒及其同事在1990年代初首次合成,并被证明是种高度活跃且异常稳定的活体内TNF抑制剂。[15][16]
这群研究人员将其发现申请专利,[17]并将所有使用权利出售给一家名为Immunex的公司(一家位于西雅图的生物技术公司),而Immunex于2002年被安进制药公司收购。[18]
依那西普是种大型分子,分子重量为150道尔顿(kDa),可与TNF结合,而降低其在人类和其他动物中发生过度发炎的作用,包括自体免疫性疾病,如强直性脊柱炎、[19]幼年特发性关节炎、干癣、干癣性关节炎、类风湿性关节炎,以及由过量TNF所介导的各种不同疾病。这种药物已被列入世界卫生组织基本药物标准清单中。[20]
医疗用途
在美国,依那西普适用的症状有:
- 中度至重度类风湿性关节炎 (RA)(1998年11月)[10][21]
- 中度至重度多关节性幼年特发性关节炎(1999年5月)[10][22]
- 干癣性关节炎(2002年1月)[10][23]
- 强直性脊柱炎 (AS)(2003年7月)[10][24][25]
- 中度至重度干癣(2004年4月)[10][26]
在欧盟,依那西普适用的症状有:
一位名为爱德华·托比尼克(Edward Tobinick)的美国医生尝试使用依那西普治疗中风和脑损伤后患者的慢性神经功能障碍,[27]并借此取得美国[28]以及外国专利。美国神经内科医师及哈佛大学教授史蒂文·诺维拉在《基于科学的医学》杂志上撰文表示,"医生在其能力和专业领域范围外执业是不道德的行为"。托比尼克为此对诺维拉提起诉讼,而最终败诉。[29]美国神经病学会对于此种治疗的建议是"无足够的证据以确定其有效性,且此种治疗方式可能会带来不良后果及巨大成本"。[30]
不良影响
FDA因为该药物引起一些严重的感染,而曾在2008年5月2日对依那西普发出黑框警告。[31]根据报导,使用依那西普会导致严重感染和败血症(包括潜伏性结核和B型肝炎感染复发),甚至是死亡。[10][32]
发生注射部位反应(例如发红和疼痛)的案例很常见,比率约为11.4%。[33]
作用机转
依那西普可降低天然生成TNF的作用,因此是种TNF抑制剂(一种可与TNF结合的诱饵受体)。[34]
TNF是种由淋巴球和巨噬细胞(两种均为白血球中的成分)产生的细胞激素,可透过吸引额外的白血球到发炎部位,以及透过引发和放大发炎的额外分子机制来介导免疫反应。依那西普能抑制TNF作用而将发炎反应减少,此对于治疗自体免疫性疾病特别有用。
TNF受体有两种:一种嵌入白血球中,透过释放其他细胞激素对TNF作出反应,另一种是可溶性TNF受体,用于导致TNF失去活性并减弱免疫反应。此外,几乎所有有核细胞的表面都有TNF受体(无核的红血球表面不含TNF受体)。依那西普可模仿天然存在的可溶性TNF受体所具的抑制作用。但依那西普不同之处是其为一种融合蛋白,而非单纯的TNF受体,因此在血液中的半衰期可大幅延长,有较深入且时间较长的作用。比天然存在的可溶性TNF受体有更持久的生物效应。[35]
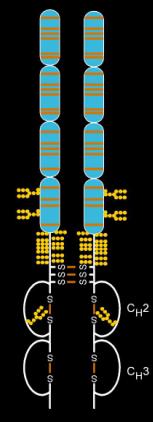
结构
依那西普由两种天然存在的可溶性人类75千道尔顿TNF受体与IgG1 Fc部分连接而成。[36]其作用是人工设计的二聚体融合蛋白。[36]依那西普是一种复杂分子,含有6个N-聚糖、最多14个O-聚糖和29个二硫化物桥结构。[37][38][39]
历史
第一个与依那西普相关的专利由Immunex于1989年9月5日提交。[40]这种原型融合蛋白是由当时在美国达拉斯德克萨斯大学西南医学中心担任学术研究员的布鲁斯·比尤特勒及其同事在1990年代初首次合成,并获得专利,而于1995年将所有使用权利出售给Immunex。[41]于麻省总医院服务的研究人员Brian Seed所发现的另一融合蛋白质技术也取得专利,并于于1997年将其授权给Immmunex。[42]
依那西普于1998年11月在美国获准作医疗用途。[10][43]
此药物于2000年2月在欧盟获准使用。[11]
社会与文化
依那西普于美国的零售价随著时间演进而持续上涨。 患者于2008年支付的费用为每月1,500美元(即每年18,000美元)。[44]到2011年,费用已超过每年20,000美元。[45][46]一家英国伦敦的医疗保险公司 - 国际健康计画联合会 (International Federation of Health Plans,简称IFHP) 于2013年所做的调查发现,美国患者于依那西普的平均费用为每月2,225美元,即每年26,700美元。[47]IFHP报告中显示美国各种健康计划的收费价格差异很大,患者中从第25个百分位数的1,946美元到第95个百分位数的4,006美元不等。[47]
在美国,依那西普的售价比其他国家为贵。[47]截至2013年,接受调查的国家的平均每月费用从瑞士的1,017美元到加拿大的1,646美元不等,而美国的平均每月费用为2,225美元。[47]
安进在美国和加拿大境内销售依那西普,而辉瑞在两国以外的国家和地区销售该药物。[45]于2010年,美国和加拿大的销售额为35亿美元,[45]同一年度在前述两国以外的销售额则为33亿美元。[48]
依那西普的专利原定于2012年10月23日到期,[49]但该药物在美国因取得第二项专利,又取得16年的独占权。[50]
在第二项专利到期之前,依那西普的通用名药物(又称学名药)似乎不太可能出现。依那西普是生物制剂,与化学制剂适用的法律不同,许多国家不允许生产生物制剂的学名药。然而欧盟,以及美国,由美国国会通过,由巴拉克·欧巴马总统签署的《2009年生物制品价格竞争和创新法案(Biologics Price Competition and Innovation Act of 2009)》)已制定批准生物制药学名药(生物相似药)的措施,但要求参与者须"实施强制临床测试和定期审查"。[51]
印度大型制药公司西普拉有限公司于2013年4月宣布在印度推出首款依那西普生物相似药(与中国上海中信国健药业有限公司(Shanghai CP Guojian Pharmaceutical Co. Ltd.)合作生产),商品名为Etacept,用于治疗风湿性疾病。[52][53]
以下有数种依那西普生物相似药获准作医疗用途:
2016年1月,Benepali被批准在欧盟使用。[54]
2017年2月,Lifmior获准在欧盟使用。[55]但于2020年2月由市场撤出。[56]
2017年6月,Erelzi获准在欧盟使用。[57]
2019年3月,YLB113(由日本YL Biologics公司生产的依那西普生物类似药)获准在日本使用。[58]
2020年5月,Nepexto获准在欧盟使用。[2]
相似药物
参考文献
外部链接
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.