小分子核糖核酸
广泛存在于植物、动物及动植物病毒等生物中的一类进化保守性的非编码小分子调控RNA 来自维基百科,自由的百科全书
小分子核糖核酸(英语:microRNA,缩写miRNA),又称微RNA[1](微核糖核酸),是真核生物中广泛存在的一种长约21到23个核苷酸的RNA分子,可调节其他基因的表达[2][3]。miRNA来自一些从DNA转录而来,但无法进一步转译出蛋白质的RNA(属于非编码RNA)。miRNA通过与目标mRNA结合,进而抑制转录后的基因表达[4],在调控基因表达、细胞周期、生物体发育时序等方面起重要作用。在动物中,一个miRNA通常可以调控数十个基因。



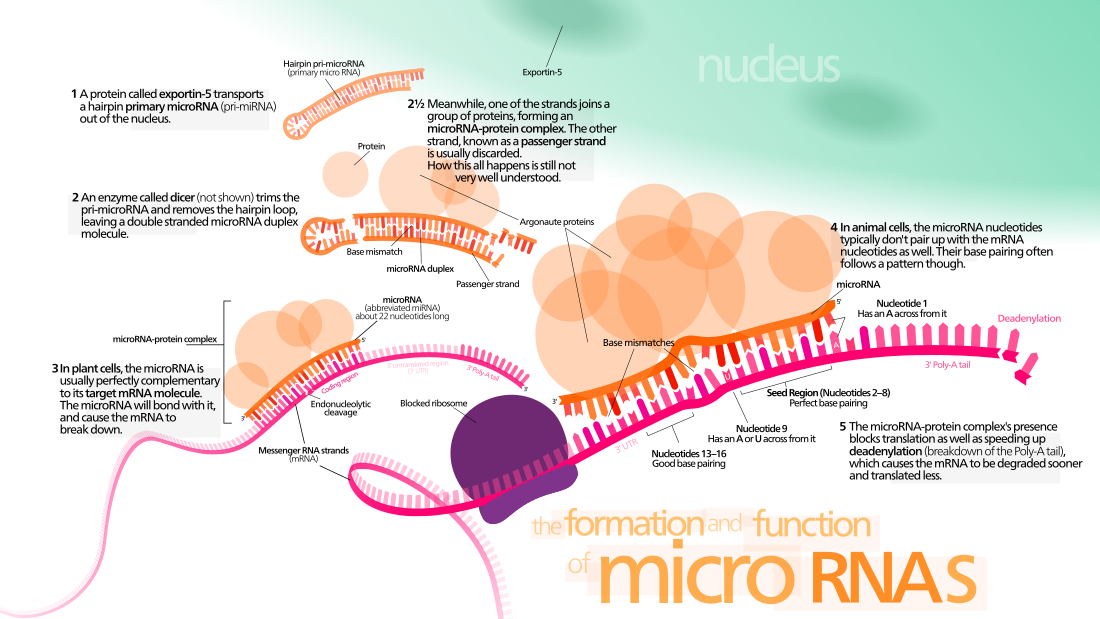
这些RNA是从初级转录本(primary transcript)出来的,也就是pri-miRNA,转变成为称为pre-miRNA的茎环结构,最后成为具有功能的成熟miRNA。
1989年,维克托·安布罗斯发现秀丽隐杆线虫(C. elegans)中有个基因lin-4抑制另一个基因 lin-14。他们认为lin-4应该也表达一种调控蛋白质,因为基因转录成RNA并翻译成蛋白质是当时认为的公理。不过1993年,维克托的学生 Rosalind Lee 和 Phonda Feinbaum 克隆出了lin-4,却发现这个基因非常小,不足以做出蛋白质,而且这个基因的产物确实也不是蛋白质,而是一个长度只有22个核苷酸的RNA,后来人们又发现此miRNA可以和其他蛋白质结合,阻断其他表现,最终产生上述的基因抑制现象。它是由单链的RNA分子产生,这个分子的一端折回来形成不完全的互补配对,称“茎环”[5]。
pri-miRNA长度大约为300~1000个碱基,pri-miRNA经过一次加工后,成为pre-miRNA即microRNA前体,长度大约为70~90个碱基;pre-miRNA再经过Dicer酶酶切后,成为长约20~24nt的成熟miRNA。实际研究中,pre-miRNA应用最早,也最广泛。近年研究发现microRNA的双臂对成熟miRNA的形成有着十分重要的作用。
与小分子siRNAs相比,miRNA在分子特性等方面是相似的,但也存在不少的差异。siRNA是双股RNA,3'端有2个非配对碱基,通常为UU;miRNA是单股RNA。siRNAs是由dsRNA在Dicer酶切割下产生,而成熟miRNAs的产生要复杂一些,首先pri-miRNA在核内由一种称为Drosha酶处理后成为大约70nt的带有茎环结构的Precursor miRNAs(pre-miRNAs),这些pre-miRNAs再在Exportin-5帮助下转运到细胞核外之后再由胞质Dicer酶进行处理,酶切后成为成熟的miRNAs。
生命的一些重要活动如幼虫的生长发育、细胞的发生和分化、神经系统的分化等都被一些非编码蛋白的小RNA的调控,而除miRNA、siRNA以外的小RNA我们目前知之甚少。
2024年10月7日,miRNA及其转录后修饰机制发现者维克托·安布罗斯和加里·鲁夫昆获得诺贝尔生理学或医学奖。[6][7]
命名规则
miR-前缀后面所跟着的数字,代表命名的顺序,比如,miR-124比miR-456发现得早。
“miR-”代表成熟的miRNA、“mir-”代表pre-miRNA和pri-miRNA、“MIR”代表编码miRNA的基因[8]。
miRNA几乎全是独一的编码顺序,但对于拥有一两个碱基不同的则会被标上字母以示,例如,miR-124a与miR-124b。 若成熟的miRNA相同,但pre-miRNA和pri-miRNA和编码他们的基因来自于不同的基因组,则使用数字来表示,例如,mir-194-1和mir-194-2表示两个pre-, pri-miRNA剪切后的成熟miRNA是完全相同的,但却是两个不同的来源。
前缀的三个字母代表了不同的种族来源,例如,hsa-miR-194代表miRNA来源于人类,oar-miR-124来源于绵羊。
对于形成pre-,pri-miRNA茎环的两端miRNA, 通常一端在数量上远远超过另一端。数量优势的一端往往称为guide strand,而另一端被称为passenger strand,通常被大量降解,用*号来表示,例如miR-124和miR-124*。
生物合成机制

有多达40%的miRNA位于其他基因的内含子或甚至外显子中[9]。他们通常(但不限于)在有义方向被发现[10][11],因此它们通常与他们宿主基因一起调节[9][12][13]。 位于DNA模板上的序列,并非成熟miRNA的最终编码:有6%的人类miRNA有RNA编辑的现象,RNA上特定位置的修饰,会产生和他们DNA不同的产物。这增加了miRNA作用的多样性和范围,远超过了基因组单独引起的作用。
miRNA基因通常由RNA聚合酶Ⅱ转录[14][15],聚合酶常常会结合到DNA序列附近的启动子,并将其编码成前miRNA的发夹环。 所得到的转录产物,上有5'端帽及多聚腺苷酸尾并已被剪接。动物的miRNA最初转录为约80个核苷酸的RNA茎环,其会交互形成几百个核苷酸长的miRNA前体,称作pri-miRNA[14][10]。当在3'UTR(3'非编码区)中发现茎-环前体时,该转录物可以作为pri-miRNA和mRNA[10]。 此外,RNA聚合酶Ⅲ也会转录一些miRNA,特别是具有上游Alu元件的、tRNA或哺乳动物宽分散重复(mammalian-wide interspersed repeats)启动子单元[16]。

单个pri-miRNA可以含有1至6个miRNA precursor,这些发夹环结构各自由约70个核苷酸组成,而每个发夹的侧翼包含了RNA加工的必要序列。 在pri-miRNA中发夹的双链RNA(dsRNA)结构,会被称为DiGeorge综合症关键区8(DGCR8或无脊椎动物中的“Pasha”)的核蛋白所识别。随后DGCR8与Drosha酵素结合形成微加工复合体(Microprocessor complex)[17][18]。
在该复合物中,DGCR8使Drosha的RNase III催化结构区域定向,借此从发夹碱基中切割约11个核苷酸,从而释放pri-miRNA的发夹弯[19][20]。所得产物在其3'端具有两个核苷酸的突出端,其也具有3'羟基和5'磷酸基团。它通常被称为前miRNA(pre-miRNA)。有许多对于有效加工重要的pre-miRNA下游的序列基序(Sequence motif),已被识别鉴定了[21][22][23]。
而对于那些绕过微加工复合体,直接剪接出内含子的前miRNA,被称为“Mirtrons”。其最初被认为只存在于果蝇和秀丽隐杆线虫中,然而现在已经在哺乳动物中发现其存在[24]。 有多达16%的pre-miRNA可以透过核RNA编辑改变[25][26][27],其中最常见地,如腺苷脱氨酶作用于RNA(ADAR)上的腺苷至肌苷(A至I)转换。另外,RNA编辑也能停止核加工(例如pri-miR-142,其会导致核糖核酸酶Tudor-SN的降解),并改变下游流程包括细胞质miRNA的加工与目标专一性(像是改变中枢神经系统中miR-376的种子区域)[25]。

核细胞穿梭蛋白Exportin-5涉及前miRNA发夹从细胞核输出的过程。这种蛋白质是karyopherin家族的一个成员,它会识别前miRNA发夹的3'末端,由RNase III酶与Drosha遗留的两个核苷酸的突出端。 Exportin-5-mediated介导运输到细胞质是能量依赖的(主动运输),其使用GTP来绑定Ran蛋白。[28]
在细胞质中,前miRNA发夹会被由RNaseIII酶Dicer所切割[29] ,该内切核糖核酸酶与miRNA发夹的5'和3'端相互作用并切除连接3'和5'臂的环[30] ,产生长度为22个核苷酸的不完全的miRNA:miRNA*双链体[29] 。整个发夹长度和环尺寸都会影响Dicer的加工效率。由于RNA的不完全配对性质,miRNA:miRNA*双链体的配对程度也会影响切割[29][31] 。
此外,一些富含G的pre-miRNA可以潜在地利用G-四联体,来替代典型的茎-环结构。 例如,人的pre-miRNA 92B就使用G-四联体,来抵抗Dicer在细胞质中的介导切割。[32] 虽然双链体的任一链,皆可作为潜在作用的功能miRNA,但通常只有一条链会掺入RNA诱导沉默复合体(RISC)中,在其中该miRNA会与其目标mRNA相互作用。
在植物中miRNA的生物合成与动物的最大差异,主要是在于核加工和输出的过程中:其不像动物使用两种不同的切割酶(一种位于核内部、一种位于核外部)。植物的两种切割,都是利用称为Dicer-like1(DL1)(Dicer同源物)进行,由于DL1仅在植物的细胞核中表达,这表明这两种切割都在核内发生。在植物miRNA:miRNA *双链体被转运出细胞核之前,其3'突出端会被称为Hua-Enhancer1(HEN1)的RNA甲基转移蛋白甲基化,然后透过称为Hast(HST)的蛋白质(Exportin 5蛋白的同源物)将双链体从细胞核运出到细胞质中,在那里它们会分解并且生成成熟的miRNA,来结合到RISC中。[33]
参考文献
外部链接
参见
Wikiwand - on
Seamless Wikipedia browsing. On steroids.