Loading AI tools
一种疾病 来自维基百科,自由的百科全书
登革热(法语:la fièvre de la dengue ; 英语:dengue fever,新马作骨痛溢血热症,又称断骨热、天狗热、骨痛热症)是一种由登革热病毒引起的由蚊媒热带病[1]。患者大约会在感染后3到14天后发作[2],症状包括发热、头痛、肌肉和关节痛,还有典型性的麻疹样皮疹[1][2]。一般会于2至7天痊愈。少部分患者病情可进一步恶化,出现危及生命的登革出血热,患者有出血、血小板减少和血浆蛋白渗出,或者进展为登革休克综合征,此时会出现致命性的低血压休克[2]。
| 登革热 | |
|---|---|
| 又称 | 登革热、骨痛热症[1][2] |
| 登革热患者常见的皮疹 | |
| 读音 | |
| 症状 | 发烧、头痛、关节痛、红疹[1][2] |
| 并发症 | 出血、血小板低下、血压过低[2] |
| 起病年龄 | 暴露后3-14日[2] |
| 病程 | 2-7日[1] |
| 类型 | 病毒感染、黄病毒属感染疾病[*]、被忽视热带病、疾病、蚊子传播的疾病 |
| 病因 | 白线斑蚊及埃及斑蚊散布的登革热病毒 |
| 诊断方法 | 侦测对抗病毒或其RNA的抗体[2] |
| 鉴别诊断 | 疟疾、黄热病、病毒性肝炎、钩端螺旋体病[3] |
| 预防 | 登革热疫苗、防蚊[1][4] |
| 治疗 | 支持疗法、静脉注射、输血[2] |
| 患病率 | 每年5000万至5.28亿例[5] |
| 死亡数 | ~20,000例[6] |
| 分类和外部资源 | |
| 医学专科 | 感染科 |
| ICD-11 | 1D2Z |
| ICD-10 | A97 |
| ICD-9-CM | 061 |
| OMIM | 614371 |
| DiseasesDB | 3564 |
| MedlinePlus | 001374 |
| eMedicine | 215840 |
| Orphanet | 99828 |
登革病毒由黑斑蚊属的几种蚊子传播,主要是埃及斑蚊(A. aegypti)[1]。登革热病毒有五型[7];感染后对同型病毒可获得终身免疫,但对异型病毒免疫力维持时间较短。且感染异型病毒会增加严重并发症的风险[1],目前的筛检方式包含侦测血液中是否存有对抗病毒或其RNA的抗体[2]。
目前已有多种登革热疫苗在某些国家上市[4]。其他预防方式包含减少斑蚊滋生地及斑蚊数目,以及避免蚊虫叮咬。方法包含移除积水或、静水加盖,以及穿著包覆衣物[1]。轻度或中度的急性登革热的治疗方式包含支持治疗,包含口给输液或静脉注射,重症则必须输血[2]。全球约有50万人因此病住院[1]。布洛芬等非甾体抗炎药(NSAIDs)不建议使用[2]。
登革热自第二次世界大战之后就成为严重的全球公众卫生议题,遍及全球110国[8][9][10]。每年有5000万至5.28亿人感染,约20,000人会因此死亡[11][5][6][12]。该病最早的爆发纪录为1779年[9],至20世纪初,人们已经了解此病由病毒引起,且经由蚊子传播[13][14]。除了灭蚊计画之外,目前科学界也致力研发直接对抗病毒的药物[15]。该病被归类于被忽视热带病之一[16]。

一般来说,登革病毒感染者80%都无症状,或者只有轻度症状如简单的发烧[11]。其它感染者中5%有严重临床症状,其中一小部分患者生命会受到威胁[11][17]。登革热潜伏期(从接触病毒到出现临床症状的时间)为3-14天,但通常为4-7天[18]。因此,从流行区域旅行归来者如果在到家后14天内没有发烧或其它临床症状,那就不太可能感染登革病毒[8]。儿童感染后常有与普通感冒或肠胃炎类似的症状(呕吐和腹泻)[19]。虽最初症状一般较轻但包括高烧,且出现严重并发症的风险更高[20]。

登革热的特征性临床表现是突发高热,头痛,后眼窝痛,肌肉及关节痛和皮疹。因为它可以导致肌肉和关节痛,所以又称为“断骨热”[11][22]。感染过程分为三个时期:急性发热期,极期和恢复期[21]。
急性发热期患者高热,体温可达40 °C(104 °F),伴有全身疼痛和头痛,通常会持续2-7天[21][22]。也可有恶心、呕吐[20]。50-80%患者中,出现症状[22][23]的第一或第二天会出现皮疹,皮肤发红,或者在病程靠后(4–7天)出现麻疹样皮疹[23][24]。也有观察到中央发白周围发红的皮疹[25]。此时,一些瘀点(小的红斑,压之不褪色,由毛细血管破裂所致[21])会出现,伴随口腔和鼻腔黏膜的少量出血[8][22]。发烧为典型的双峰或马鞍热,发热1-2天后体温降至正常[24][25]。
在高烧消退后,一些病人的病情进展到极期[20]。在这一时期,有血浆蛋白渗出,一般持续1-2天[21]。这可能导致液体积聚在胸腹腔,循环系统中液体量减少,重要器官的血液供应量减少[21]。也可能会发生器官功能障碍和严重出血,特别是消化道出血[8][21]。仅有不到5%的患者会出现休克(登革休克综合征)和出血(登革出血热)[8],然而曾感染过其他血清型登革病毒的患者(二次感染)休克和出血的风险会增加[8][26]。极期,虽然罕见,但相对来说在儿童和青少年中更常发生[20]。

接着出现恢复期,渗出的液体被重吸收入血[21],这通常持续2-3天[8]。改善往往非常明显,可伴有严重瘙痒和心跳过缓[8][21]。另一种皮疹为斑丘疹或血管炎样,随之有脱皮[20]。在此期,可能发生体液过多,如果影响到了大脑,可能会导致意识水平下降或癫痫[8]。成年人的乏力感可能持续数周[20]。
登革热偶尔会影响其他身体系统[21],单独或伴随着典型的登革热症状[19]。严重病例中0.5-6%会发生意识不清,这是由病毒导致的脑组织炎症所致或重要器官例如肝脏的损伤间接引起[19][25][27]。
在登革热中,其他神经系统疾病已被报道,如横贯性脊髓炎和格林-巴利综合征[19][27]、飞蚊症[28]。罕见的并发症有心脏感染和急性肝衰竭[8][21]。
登革热病毒(DENV)为核糖核酸病毒(RNA)病毒,属于黄病毒科(Flaviviridae)中的黄病毒属(Flavivirus)。同属的其它病毒包括黄热病毒、西尼罗河病毒、圣路易斯脑炎病毒、日本脑炎病毒、蜱传脑炎病毒、科萨努尔森林病病毒和鄂木斯克出血热病毒[25]。它们多通过节肢动物(蚊子或蜱)传播,因此被称为虫媒病毒(节肢动物传播的病毒)[25]。
登革病毒基因组(遗传物质)包括大约11,000个核苷酸碱基,编码形成病毒颗粒的三种不同蛋白质分子(C、prM和E)和七种其它蛋白质分子(NS1、NS2a、NS2b、NS3、NS4a、NS4b、NS5),这七种蛋白分子只在受感染宿主细胞内可见,是病毒复制所需[26][29]。有五个[30]病毒株,称为血清型,其中前四种称为DENV-1、DENV-2、DENV-3和DENV-4[31],第五种血清型在2013年被宣布[30]血清型之间的差异是基于他们的抗原性[32]。

登革病毒主要由黑斑蚊传播,特别是埃及斑蚊[31]。这些蚊子通常生活在北纬35度到南纬35度海拔1,000米(3,300英尺)以下[31]。他们一般白天叮咬,特别是清晨和傍晚[33][34],但是全年任何时间他们都可以叮咬并传播病毒[35]。其它传播该疾病的斑蚊包括白线斑蚊(A. albopictus)、波利尼西亚斑蚊(A. polynesiensis)和盾板斑蚊(A. scutellaris)[31]。人类是该病毒的主要宿主[31][25],但其也在非人类的灵长目动物中传播[36],叮咬一次即可感染[37]。雌蚊从登革热患者处吸入带病毒血液,在最初的2-10天发热期,蚊子自身感染病毒,病毒在其消化道细胞中[38],大约8-10天后,病毒到了蚊子的唾液腺等其它组织,随后被释放在唾液中。病毒对蚊子似乎没有有害作用,蚊子可终生保持感染状态。埃及斑蚊最易传播病毒,因为他们更喜欢在人造水容器中产卵,生活在人类附近,以人而不是其它脊椎动物为食[18]。
登革病毒也可以通过被感染的血制品及器官捐赠来传播[39][40]。在新加坡等国,登革热流行,据估计每10000次输血中有1.6到6次可能感染登革病毒[41]。怀孕或分娩过程中的垂直传播(从母亲到胎儿)已有报道[42]。其它人对人的传播方式也有报道,但很少见。[22]登革病毒的遗传变异有地区特异性,提示在新的区域形成流行很罕见,尽管数十年来登革热正在新的区域出现[20]。
婴幼儿中重型登革热更常见,和许多其它感染相比,登革热在相对营养良好的儿童中更常见,其它导致重型登革热的危险因素包括女性,高的身高体重指数[20]和病毒载量[43]。虽然每个血清型都能导致所有该病的临床表现[26],但病毒株(血清型)是一个危险因素[20]。人们认为感染某一血清型后会对该型产生终身免疫,但对其它三型的保护免疫只有较短时间[31][22]。如果曾经感染过血清型DENV-1的人又感染了DENV-2或DENV-3,或者之前感染过DENV-3的人又感染了DENV-2,发生重型感染的风险会增加[29]。对于患有糖尿病和哮喘等慢性病的人群,登革热具有生命威胁[29]。
某些特定基因的多态性(正常变异)与登革热严重并发症的风险增加有关联,例如编码TNFα、甘露聚糖结合凝集素[11]、CTLA4、TGFβ[26]、DC-SIGN、PLCE1这些蛋白的基因及HLA-B基因变异后产生的特殊形式的人类白细胞抗原[20][29]。特别是在非洲人中,一种常见的葡萄糖-6-磷酸脱氢酶缺乏症似乎会增加此风险[43]。而编码维生素D受体和FcγR 的基因似乎可以防止患者在二次感染中发生严重并发症[29]。
当携带登革病毒的蚊子叮咬人,病毒会随其唾液进入皮肤,与白细胞结合并进入,随白细胞在全身循环并在其内增殖,白细胞对病毒做出反应,产生大量信号蛋白,如细胞因子和干扰素,他们导致许多临床症状,如发热、流感样症状和剧痛。在严重感染时,体内产生的病毒数量大大增加,更多器官(如肝和骨髓)会受累。由于血管通透性增加,血管内液从小血管渗出进入体腔。结果血管内循环血量减少,血压变得很低不能给重要器官供应足够血液。而且骨髓基质细胞受感染导致骨髓功能障碍,凝血必需的血小板数目减少,这使另一个主要的登革热并发症—出血的风险增加[43]。
进入皮肤后,登革病毒结合于朗格汉斯细胞(皮肤内识别病原体的一群树状细胞)[43],通过病毒蛋白与朗格汉斯细胞膜蛋白-特别是称为DC-SIGN的C-型凝集素、甘露糖受体和CLEC5A的结合,病毒进入细胞内[26]。DC-SIGN是树突状细胞上异物的非特异性受体,似乎是病毒进入的主要途径[29]。树突状细胞迁移到最近的淋巴结,同时,病毒基因组在内质网上的有膜的囊泡内转变,内质网是细胞的蛋白合成装置,产生新的病毒蛋白用于病毒RNA复制和形成病毒颗粒。未成熟的病毒颗粒转运到高尔基体,在那里一些蛋白会获得必需的糖链(形成糖蛋白)。之后病毒成熟,通过出芽方式到感染细胞表面,经胞吐作用释放。这时他们有能力进入其他白细胞,如单核细胞和巨噬细胞[26]。
受感染细胞的第一反应是产生干扰素,其为细胞因子,通过作用于先天免疫系统,增加JAK-STAT信号通路介导的一大群蛋白质的产生来增强对病毒感染的防御。一些血清型的登革病毒似乎有办法减缓这一进程。干扰素也可以激活后天免疫系统,导致抗病毒抗体产生、T细胞直接攻击受病毒感染的细胞[26]。机体产生了各种抗体,有些和病毒蛋白紧密结合,标记病毒以供吞噬(特定细胞摄入并破坏病毒),但有些和病毒结合不够紧密,介导病毒进入一部分吞噬细胞后病毒不会被破坏,反而会进一步增殖[26]。
二次感染时感染异型登革病毒导致登革出血热和登革休克综合征的风险增加,但原因尚不完全明确。普遍认可的假说是抗体依赖性增强作用(ADE),但其背后的具体运作机制还不清楚。可能是由于非中和性抗体和病毒结合不够紧密,且进入白细胞内错误的细胞器,而这些白细胞已经吞噬了并准备杀伤病毒[26][29]。人们怀疑ADE不是严重的登革相关并发症的唯一致病机制,[11][27]不同研究都提示T细胞和可溶性分子如细胞因子和补体系统也可能发挥作用[43]。
重型登革热的特点是毛细血管通透性(允许正常情况下存在于血液中的液体和蛋白穿过血管壁)增加和凝血功能障碍[19][20]。这些改变和内皮细胞糖萼的异常有关,糖萼是血液成分的分子筛[20]。人们认为毛细血管渗漏(和极期)是由免疫反应所致[20]。其它人们感兴趣的过程包括受感染细胞坏死影响了凝血和纤溶系统(参与凝血和溶血的两个对立系统)和参与正常凝血过程的血小板数目减少[43]。
| 不断加剧的腹痛 | ||||
| 持续呕吐 | ||||
| 肝脏肿大 | ||||
| 黏膜出血 | ||||
| 血细胞压积偏高,血小板减少 | ||||
| 嗜睡或者焦虑 | ||||
| 浆膜腔积液渗出 | ||||
登革热确诊一般基于临床表现和体格检查,特别是在疫区[11]。但是感染早期可能很难和其他病毒感染相鉴别[8]。当发现生活在疫区的人有发烧和以下症状(恶心和呕吐、皮疹、全身痛、白细胞计数减少、束臂试验阳性,或者任何警示信号(见表格))中的两种,可能性诊断就是感染了登革病毒[44]。警示信号通常出现在严重登革热之前[21]。在没有条件做实验室检查时,束臂试验非常有用,用血压袖带对前臂局部加压五分钟,压力在舒张压和收缩压之间,然后计数新的点状皮下出血;如果出血点数目大于每平方英寸10到20(1平方英寸等于6.25平方厘米),患者就可能患有登革热[21][45]。
任何人在热带或亚热带地区两周内出现发烧症状都应该考虑诊断为登革热[20]。鉴别登革热和基孔肯雅热可能很困难,因为基孔肯雅热和登革热皆为病毒感染,有许多相同症状,流行地区也和登革热类似[22]。通常需要通过实验室检查来排除其它可导致类似症状的疾病,如:疟疾、钩体病、病毒性出血热、伤寒、球菌性脑膜炎、痳疹和流感[8][46]。
实验室检查可见的最早改变是白细胞计数减少,随之可能有血小板减少和代谢性酸中毒[8]。肝脏转氨酶AST(谷草转氨酶)和ALT(谷丙转氨酶)水平中度升高通常和血小板、白细胞减少有关[20]。在重型登革热中,血浆渗出导致了血细胞压积和低白蛋白血症[8]。胸腔积液或腹水在量多时体检可发现[8],但是超声下看到积液可能有助于登革休克综合征的早期确诊[11][8]。但在很多情况下,都没有超声设备可供使用[11]。病人血压下降到登革休克综合征≤ 20 mm Hg和外周血管塌陷则说明出现了登革休克综合征[20]。在儿童中,毛细血管再灌注延迟,心率加快,四肢厥冷则可判断出现了外周血管塌陷[21]。尽管警示信号是早期检测到潜在的严重登革热的一个重要方面,但没什么特定的临床或实验室检测指标可以提供证据[47]。
世界卫生组织2009年颁布的分类法把登革热分为两组:普通型登革热和严重登革热[11][44]。WHO 1997年的分类法虽然因为太局限且复杂,被其取代,但还在广泛使用[44],包括WHO东南亚地区办事处直到2011年还在使用该旧的分类法[48]。严重登革热之所以严重是因为它和严重出血、严重器官功能障碍或严重血浆渗出有关,而其他病例都属于普通型[44]。1977年的分类法将登革热分为:未分类发热,登革热和登革出血热,登革出血热又被进一步分为I–IV级[8][49]。Ⅰ级指患者发烧,容易有瘀伤或束臂试验阳性,Ⅱ级指出现皮肤及其它部位自发性出血,Ⅲ级指有临床休克表现,Ⅳ级指严重休克以致监测不到血压和脉搏[49]。III 和 IV级称为“登革休克 综合征”[44][49]。

微生物实验室检查可确诊登革热[44][50]。可以通过细胞培养分离病毒,PCR检测病毒核酸,病毒抗原(如NS1)检测或特异性抗体检测(血清学检测)[29][46]。病毒分离和核酸检测比抗原检测精确的多,但是因为费用昂贵没有得以广泛使用[46]。在初次感染的发热期检测NS1敏感性可能超过90%,但再感染时检测的敏感性只有60-80%[20]。在该病早期可能所有检测都是阴性[8][29]。在感染最初7天内,PCR和病毒抗原检测要更精确[20],而2012年出现了一种PCR检测法,可以在用于诊断流感的仪器上进行,这可能会使用PCR诊断变得更容易[51]。
除了血清学检查外,其它这些实验室检查都只在该病急性期有诊断价值。在感染后期,检测登革病毒特异的IgG 和 IgM 抗体,有助于确诊。初次感染后检测到的 IgM 滴度最高,但再次感染时也会产生IgM。初次感染后30-90天 IgM 就检测不到了,但再次感染后时间要短些。相比之下 IgG 阳性可持续超过60年,在没有临床症状时,IgG 提示既往感染。在初次感染中,血中 IgG 在14-21天后达到高峰。再感染时,IgG 达到峰值更早,滴度也通常更高。IgG 和 IgM 都可以提供对所感染的这个血清型的病毒的免疫保护[18][22][29]。在检测 IgG 和 IgM 时,可能会和其它黄病毒发生交叉反应,导致近期感染后或接种黄热病毒和日本脑炎病毒后出现假阳性[20]。单独 IgG 检测阳性不能确诊,除非每隔14天收集血液样本,检测到特异性 IgG 滴度增加四倍以上。有症状者,检测到 IgM 具有诊断意义[18]。

WHO推荐了一个综合传病媒介控制计划,包括以下5个元素:[33]
控制埃及斑蚊的主要方法是消灭其滋生地[33],具体措施是清除开放水源,如果不行,就喷洒灭蚊剂或生物控制剂[33]。一般喷洒的是有机磷酸酯或拟除虫菊酯类杀虫剂,虽然其效益备受质疑(台湾常有喷药造成严重困扰但没几天蚊子就回复原数量的抱怨)[17]。考虑到杀虫剂对健康的负面影响、容易杀死宠物、流浪动物甚至破坏生态(毒性较低的除虫菊精类对猫及水生生物仍是剧毒,在法规允许破门喷药的台湾已造成多起悲剧)、抗药性问题及生物控制剂使用上更大的物流困难,通过改善环境减少积水是首选控制措施[33]。人们可以通过穿完全遮盖皮肤的衣服,休息时使用蚊帐,或使用驱虫剂(最有效的是DEET)来防止被蚊子叮咬[37]。然而,这些方法看上去还不够有效,因为一些地区登革热爆发的频率似乎还在上升,这可能使因为城镇化增加了埃及斑蚊的栖息地。可能是由于气候变化,发病的区域范围貌似还在扩大[30]。
较为治本的方法则是改善都市中道路及排水沟的泄水坡度,移除废弃轮胎跟盆栽、大水缸及填平闲置庭院中的水池,减少积水情况的发生,才能彻底隔离蚊子跟人的生活场域。
登革热病毒没有获得批准的疫苗[11],因此预防依赖于避免被传播病毒的蚊子叮咬[33][52]。 即将上市的登革热疫苗是降低登革热发病率及严重性的新希望。
2016年,一只只有部分效力的由骨痛热症疫苗在菲律宾与印尼开始发售[4][53];而在墨西哥、巴西、萨尔瓦多、哥斯大尼加、新加坡及巴拉圭亦已批准这种疫苗的使用[53][54]。在印尼,要注射这三剂疫苗需要美金207元[53]。
但法国赛诺菲巴斯德研发的抗登革热疫苗Dengvaxia在菲律宾使用时疑似出现14名儿童死亡。赛诺菲则表示,Dengvaxia对患过登革热的接种人有效,但它不能对抗所有登革热毒株[55],另外未感染者接种后可能出现更严重的症状,并坚称接种疫苗不会死亡。菲律宾卫生部最终在2018年1月停止了Dengvaxia的接种和销售[56]。
国际抗登革热日为每年6月15日[57]。这一想法在2010年首次达成一致,第一个抗登革日是2011年在印度尼西亚的雅加达举行的[57]。2012年是在缅甸仰光,2013年是在越南[57]。设立这一日期的目的是提高对登革热的公众意识,调动资源对其进行预防和控制,还有表明亚洲地区战胜这一疾病的决心[58]。
针对登革病毒没有特异的抗病毒药,但是保持体液平衡很重要[20]。治疗取决于临床表现[59]。可以喝水,排尿的病人,没有“警示信号”,身体其它方面健康的话,可以在家中治疗,每天随访,口服补水液治疗[59]。有其他健康问题的患者,有“警示信号”或不能做到定期随访,应该住院接受治疗[8][59]。患有重型登革热者应该待在靠近ICU的地方[59]。
如果需要对患者进行静脉补液,一般只持续一两天[59]。通过滴定补液确保尿量为0.5–1 mL/kg/h,生命征象平稳,红细胞压积正常[8]。建议注射最小的所需量[59]。鉴于出血风险高,避免进行侵入性医疗措施如鼻胃管插管、肌内注射和动脉穿刺[8]。用扑热息痛(对乙酰氨基酚)来治疗退烧及不适,而NSAIDs(非甾体抗炎药)例如布洛芬和阿司匹林要避免用因为他们可能会加重出血风险[59]。当病人生命体征不平稳,血细胞压积减少时,不用等血红蛋白浓度下降到预定的“输血指针”的水平,而是应该及早输血[60]。推荐输浓缩红细胞或全血,一般不输血小板和新鲜冷冻血浆[60]。没有足够证据确定皮质类固醇在登革热中的作用是正面还是负面[61]。
在恢复期,要停止静脉补液,以免出现液体超负荷状态[8]。如果出现了液体超负荷而重要器官状态平稳,可能只需要停止继续补液就可以[60]。如果病人不在极期,可以用袢利尿剂例如呋塞米头来减少循环系统中的液体量[60]。
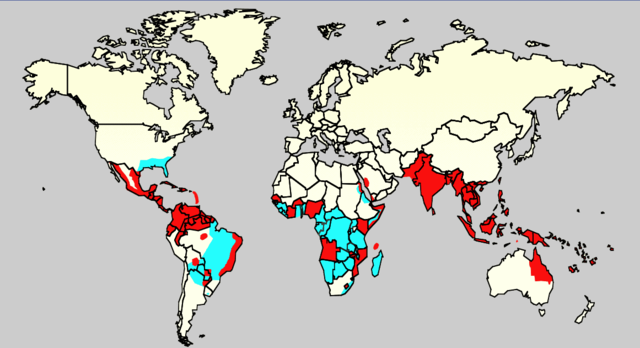
多数登革热患者康复后没有任何后续症状[44]。病死率为1-5%[8],治疗充分的话病死率小于1%[44];但是那些血压严重降低的患者病死率可能高达26%[8]。登革热在110多个国家中都很常见[8]。世界范围内一年有5000万到5亿2800万人被感染,导致50万人住院[11][5]。大约25000人死亡[19]。在21世纪前十年,据估计南亚12个国家每年有大约300万人感染登革病毒,6000人死亡[62]。非洲至少22个国家报道有登革热病例,但是似乎在所有非洲国家都有登革热出现,20%的人有感染危险[63]。这使登革热成为世界上最常见的虫媒传播病之一[47]。
感染最常发生在城镇环境中[18]。最近几十年,由于农村、乡镇和城市的扩张,而这些地方登革热常见,加上人员流动性的增强,都增加了传染病和流行病毒的数量。因此,登革热这个过去仅局限于南亚的传染病,现在已经播散到了中国南方、太平洋和美洲的国家[18],也可能会对欧洲构成威胁[17]。
在1960年到2010年间,登革热感染率增加了30倍[64]。这是城市化、人口增长、跨国旅行增加和全球变暖几个因素的综合作用[11]。该病地理分布围绕赤道。在登革热常见地区居住的25亿人中,70%来自亚洲和太平洋[64]。从发展中国家旅行归来的人如果出现发烧,最先考虑的是疟疾,其次就是登革热[22]。登革热是最常见的由节肢动物传播的病毒性疾病[26],每100万人的疾病总量估计在1600失能调整生命年[29]。世界卫生组织(WHO)将登革热计入17个被忽视的热带病之一[65]。
和大多数虫媒病毒一样,在自然界中,登革病毒的传播以吸血节肢动物作为媒介,脊椎动物为宿主[18]。病毒主要在南亚和非洲森林中从雌性斑蚊-除了埃及斑蚊之外的属-传播给它们的后代和较低级灵长类动物[18]。在城镇,病毒主要通过高度居家的埃及斑蚊来传播,在农村,病毒通过埃及斑蚊和其它斑蚊属如白线斑蚊传播给人[18]。这两个斑蚊属在20世纪后半期所在地区范围都扩大了[20]。在所有环境中,被感染的低级灵长类动物和人以一种称为扩增的方式使流行的登革病毒数量增加[18]。
第一个可能的登革热病例在中国晋朝时的一本医学百科全书中有记载,该书称之为和飞虫有关的“水毒”[66][67][9]。一部分是由于全球化,其次是奴隶贸易,在15到19世纪,主要的传播媒介埃及斑蚊从非洲向别的地方散布[20]。在17世纪已有登革热流行的描述,但最可信的关于登革热流行的早期报道是来自1779和1780年,那时该传染病席卷了亚洲、非洲和北美[9]。从那时起直到1940年,登革热流行就少见了[9]。
在1906年,人们确认登革热由斑蚊传播,在1907年,登革热是继黄热病之后第二个被证明是由病毒所致的疾病[13]。约翰·伯顿·克莱兰和约瑟夫·富兰克林·塞勒的进一步研究使对登革病毒传播方式的基本理解更加完整[13]。
1993年学者也证实白线斑蚊确实具有传播一型骨痛热病毒之能力,白线斑蚊在台湾之分布较埃及斑蚊广,且大部份地区密度均高于埃及斑蚊,故白线斑蚊仍为不可忽视的骨痛热病媒蚊之一[68]。
2014年中国广东一带爆发,截止至2014年9月29日零时全省公确诊病例 11867 例,比去年同期(663例)大幅上升1689.89%,死亡病例累计4例(其中广州3例,佛山1例),是广东首次出现破万的确诊病例,也是广州近十年来首次出现死亡病例[69]。
2015年台南市登革热疫情较为严重, 已确诊病例4万人[70],死亡病例218人[70]。
二战期间和之后登革热的显著播散被认为是因为生态的破坏,这同样也导致了不同血清型的病毒播散到了新的地区,也导致了登革出血热的出现。这一登革热的严重类型第一次报道是在1953年的菲律宾;到20世纪70年代,登革热已经变成了儿童病死的主要原因,也已经出现在太平洋和美洲[9]。在1981年的中南美洲,科学家发现,数年前感染过DENV-1的人,不但没有对于DENV-2产生免疫力,反而诱发更致命的症状,于是将其命名为登革出血热和登革休克综合征[25][71]。

“登革”的名称是从西班牙文“Dengue”音译而来,但词汇的起源众说纷纭。最普遍的说法是来自斯瓦希里语的短语“Ka-dinga pepo”中的dinga,这个短语描述该病是由邪灵导致的[67]。
在台湾,书面语称之为登革热,台湾话则称天狗热,源自于日文“デング”(亦为Dengue的音译),“デング”与“天狗”谐音,是一种不祥的妖怪,象征其病之难治;而中国大陆和港澳地区称为登革热。在新马被称为骨痛热症或蚊症。在越南通称为热出血症。据说西印度群岛上感染过登革热的奴隶据说走路的姿势像花花公子,所以该疾病被称为“花花公子热”[72][73]。
在美国一篇1789年的关于费城登革热流行的报告中,内科医生同时也是美国的建国之父本杰明·拉什使用了“断骨热”(“骨折热”)这一术语。在报告标题中他使用了更正式的术语“胆汁质缓解发热”[74]。登革热这一术语在1828年后才开始通用[73]。其它历史上的术语还包括“breakheart fever”和“la dengue”[73]。描述重型登革热的术语包括“感染性血小板减少性紫癜”和“菲律宾出血热”、“泰国出血热”或“新加坡出血热”[73]。

预防和治疗登革热的研究包括通过各种方式控制传播媒介[75],开发疫苗和研究抗病毒药[76]。
至于传播媒介的控制,很多新方法已用于减少蚊子数量,取得了一些成效,包括:将孔雀鱼和桡足虫放在积水中来吃蚊子幼虫[75]。人们也在尝试用沃尔巴克氏体属细菌感染蚊子种群,使蚊子对登革病毒部分排斥[20][77],也尝试了对雄性埃及斑蚊进行基因改造,然后释放到自然界与雌性交配,使他们的后代飞不起来[78]。
有一些进行中的项目在研制可以一次抵御所有四种血清型的登革疫苗[52],现在需要把第五种血清型算进来[30]。人们的担心是:疫苗可能通过抗体依赖性增强(ADE)增加重型登革热发生的风险[79]。理想的疫苗是:接种一次或两次后安全有效、 覆盖所有血清型、不会导致ADE、方便运输和储藏、价格实惠且性价比高[79]。2012年起,人们对很多登革疫苗进行试验[34][79],最成熟的一种疫苗是黄热病毒和四种登革热病毒血清型的弱毒株的混合物[34][80]。两项关于一种登革疫苗的研究发现它有效率为60%,重型登革热病例的80-90%可得以避免[81][82]。该疫苗的第一个产品有望在2015年上市[52]。
除了努力控制埃及斑蚊的播散及开发登革疫苗外,人们也在努力研制抗病毒药物,这些药物可用于治疗登革热及避免严重并发症的发生[83][15]。发现病毒蛋白结构可能对开发有效药物有帮助[15]。第一种方法是抑制病毒的RDRP(RNA依赖的RNA聚合酶,由NS5编码),该酶可以用核苷类似物复制病毒的遗传物质,第二种是开发特异的接合病毒蛋白的病毒蛋白酶(由NS3)的蛋白酶抑制剂[84]。最后,也可以开发进入抑制剂,阻止病毒进入宿主细胞,或者开发针对病毒复制所需的5'端帽过程的抑制剂[83]。
近期研究发现 , 如抗体结合点位为表面E糖蛋白的结构域I和II , 则不但抗体中和效力差且会和登革热其他型及其他黄病毒科如西尼罗河病毒(WNV) 、黄热病病毒(YFV)及兹卡病毒产生抗体依赖性增强(antibody dependent enhancement,ADE)导致更严重的症状(如登革出血热DHF)。但如果抗体结合点位为表面E糖蛋白结构域III , 则为特异性抗体具强中和性且不会和其他黄病毒科产生ADE , 是未来疫苗研发须注意的重点。[85]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.