超共轭效应
来自维基百科,自由的百科全书
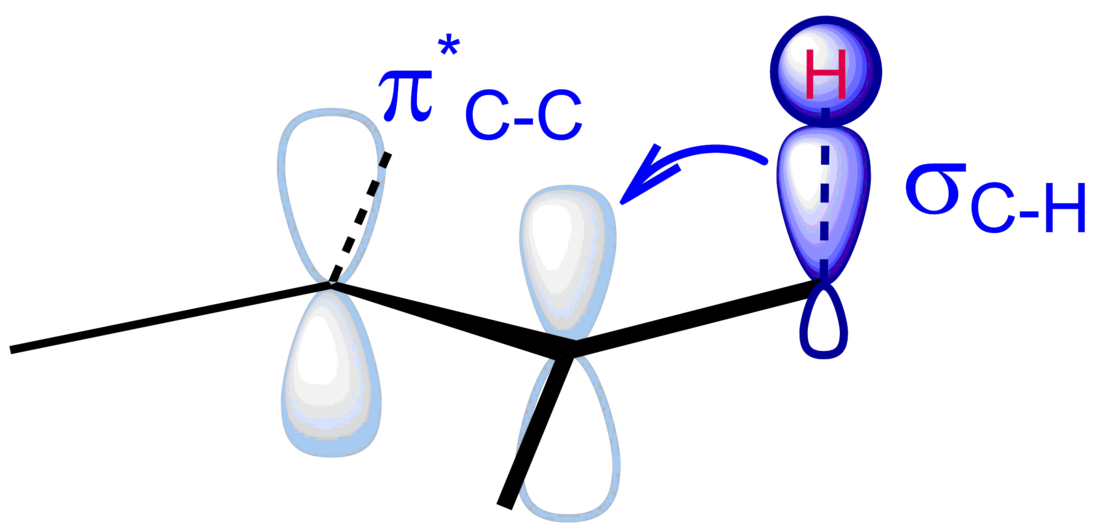
超共轭效应(英语:hyperconjugation,亦称σ-共轭或非键共振[1])在有机化学中用来描述一个σ键里的电子(通常是C-H键)与相邻未填满的非键P轨道或反键π*轨道(或σ*轨道)间发生的相互作用,该相互作用能够使整个体系变得更稳定,这是由于该作用能够生成一个较大的分子轨道。[2]对于一个碳阳离子来说,只有位于正电荷β位的键上的电子能够通过超共轭来稳定整个碳正离子。

历史
1939年,罗伯特·S·马利肯在他关于紫外光谱和共轭分子的研究中首次提出超共轭概念。[3] 他观察到随着烯上的烷烃增多,吸收光谱移向长波长端,即红移,他也首次提出造成取代烯烃的氢化热较低的原因是超共轭效应。在超共轭这个概念提出之前,人们已经在1935年提出了贝克-内森效应,并尝试用共轭效应来解释这一现象[4][5]。
应用
超共轭也可以解释很多其他的化学现象,例如端基异构效应、偏转效应、β-矽基效应、环外羰基的振动频率以及取代碳正离子的稳定性等。根据量子力学模型的推导,交叉式构象的优先性也可以由超共轭效应来解释,而不是老的教科书提到的位阻效应。[6][7]
超共轭效应能影响分子的结构与化学性质,主要体现在:[8][9]
- 键长:超共轭效应使σ键键长变短。例如,1,3-丁二烯与丙炔中C–C单键键长均为1.46Å,小于一般的C-C单键键长。对于1,3-丁二烯,可由电子离域解释,而丙炔无交叉的C-C双键,没有离域大π键,其C–C单键键长小于一般值是炔基的π键与甲基C-H键的σ-π超共轭导致的。
- 偶极矩:1,1,1-三氯乙烷相比氯仿偶极矩大得多,这可能是氯仿中氯的p轨道与C-H键之间的超共轭减小了电子偏向氯的程度的缘故。
- 生成热:有超共轭效应的分子,生成热大于键能的总和;丙烯的氢化热小于乙烯,1-丁烯氢化热大于丙烯。
- 碳正离子的稳定性:(CH3)3C+ > (CH3)2CH+ > (CH3)CH2+ > CH3+。C–C σ键可自由旋转,碳正离子β位的C-H键能与其空p轨道发生σ-p超共轭而使其稳定。能发生超共轭的C-H键越多,碳正离子越稳定。
参见
参考文献
Wikiwand - on
Seamless Wikipedia browsing. On steroids.