热门问题
时间线
聊天
视角
胚胎干细胞
取自囊胚中内细胞群的多能性干细胞 来自维基百科,自由的百科全书
Remove ads
胚胎干细胞(Embryonic stem cell,简称ESC)是一类具有多能性的干细胞。在卵细胞受精后,受精卵经过桑葚胚阶段,进入囊胚阶段。囊胚中的细胞可以归入两个大类:滋养层(trophoblast,TE)和内细胞群(inner cell mass,ICM)。滋养层的细胞会分化为胚胎外的组织(胎盘等),内细胞群的细胞则会分化成胚胎的其馀结构。分离内细胞群细胞并进行体外(in vitro)培养,即可取得胚胎干细胞。胚胎干细胞拥有分化为三个胚层的细胞的潜能,或者说在一般情况下能分化形成除了胎盘之外的所有胚胎结构,此为胚胎干细胞多能性的具体体现。
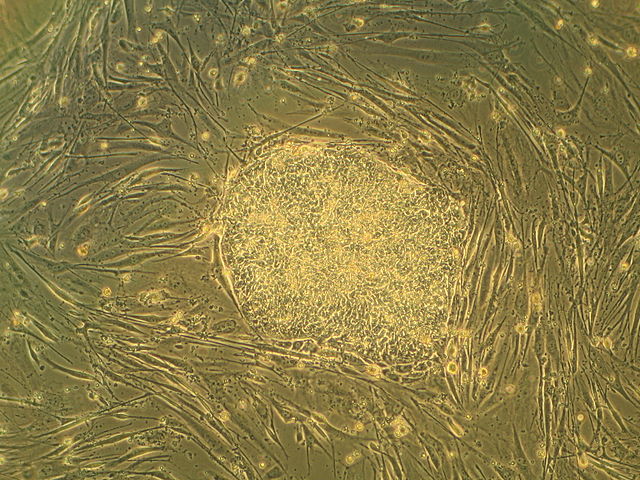
1981年,英国剑桥大学遗传学部中,两个分别由马丁·埃文斯(Martin Evans)以及马修·考夫曼(Matthew Kaufman)率领的研究团队分别在体外建立了小鼠胚胎干细胞系[1]。而胚胎干细胞这一术语则是由加州大学旧金山分校(UCSF)解剖学部的教授盖尔·马丁(Gail R. Martin)于当年12月的一篇论文中首次提出[2]。1998年,威斯康星大学教授詹姆斯·汤姆森(James Thomson)等人成功建立了人胚胎干细胞系。2007年,马丁·埃文斯与另外两名科学家因“利用胚胎干细胞引入特异性基因修饰的原理上的发现”而获得当年诺贝尔生理学或医学奖。
胚胎干细胞被认为在再生医学、组织工程、药物实验等领域拥有广阔的应用前景,胚胎干细胞对发育生物学的基础研究也有很大助益。但是,因为道德、宗教与法律上的问题(比如目前分离胚胎干细胞的方法会无可避免地杀死胚胎),有关胚胎干细胞的研究(即治疗性克隆)在各国都受到了一定的限制[3][4]。
Remove ads
性质与特征

下:由人胚胎干细胞分化而成的神经元细胞
胚胎干细胞来自囊胚的内细胞群(ICM),并进行体外(in vitro)培养取得。胚胎干细胞具有多能性,在一定条件下能够分化为三个胚层(外胚层、中胚层、内胚层)的细胞,形成生物体的各种结构。胚胎干细胞的形态与基因表达情况与其他细胞有明显的不同[5]:8[6]。
胚胎干细胞为球状,人胚胎干细胞直径约为14μm,而鼠胚胎干细胞直径约为8μm[7]。胚胎干细胞的细胞核一般较大,核仁明显,而细胞质相对较少。人和小鼠的胚胎干细胞都能在培养皿上形成圆形、边界清晰、表面光滑的细胞集落[5]:8。
胚胎干细胞多能性的维持依赖于SOX2、Oct4、Nanog等因子构成的转录网络,确保与细胞自我更新能力有关的基因能够持续高水平表达,并抑制与分化、自噬相关的基因转录。在胚胎干细胞的分化过程中,细胞的基因表达情况会发生很大变化,尤其是与胚胎干细胞自我更新能力维持有关的基因[5]:29-36[6]。
胚胎干细胞的自我更新和分化与表观遗传学途径有密不可分的联系。首先是组蛋白的化学修饰:在胚胎干细胞中,与自我更新相关的基因所在区域组蛋白H3K27高度乙酰化,这些区域中既有组蛋白乙酰基转移酶,也有去乙酰化酶。这两种作用效果完全相反的酶使H3K27的乙酰化水平维持动态平衡,便于基因能在外界信号发生改变时迅速关闭。另外,PRC1与PRC2两种重要的蛋白质会使H3K27、H3K4发生甲基化而沉默与分化相关的基因,使其不表达。胚胎干细胞多能性的维持与RNA干扰也有紧密联系。比如,PRC1与PRC2还会沉默编码与分化相关的miRNA,使胚胎干细胞维持多能性;而let-7(一种miRNA)的表达则会使胚胎干细胞开始分化。受精卵发育早期,基因组所有的DNA甲基化都会由甲基转移酶Dmnt1消除;而与胚胎干细胞自我更新有关的基因区域会在分化过程中再次甲基化,这些基因的表达也随之停止[5]:29-36[6]。
胚胎干细胞多能性的维持还需要依靠胞外微环境提供适宜的信号,否则,胚胎干细胞很容易分化为其他类型的细胞。过去,胚胎干细胞的培养需要在有一层喂养层细胞的培养基上进行。喂养层细胞一般是经丝裂霉素等有丝分裂阻断剂处理过的胚胎成纤维细胞,这些细胞能分泌特定的信号分子模拟早期胚胎发育的微环境,使胚胎干细胞维持不分化的状态。目前,在培养基内加入白血病抑制因子(LIF)等细胞信号分子就能够在无喂养层的培养基上培养胚胎干细胞[8][6]。
分离、鉴定与培养

分离囊胚的内细胞群(ICM)细胞,再进行体外培养即可取得胚胎干细胞。目前,取得胚胎干细胞的方法已有一定改进,但仍无可避免地会杀死胚胎[5]:5。
囊胚由两大部分构成:处于外围的滋养层以及处于内部的内细胞群。滋养层细胞会分化为胚胎外的组织(胎盘等),而内细胞群则会分化为胚胎的各种结构[5]:3-5。
最早期分离胚胎干细胞的方法是先用蛋白酶分解透明带的蛋白质(囊胚外围的一层细胞外基质),再利用免疫手术(immunosurgery)专一地使滋养层细胞裂解,从而取得内部的内细胞群细胞,之后体外培养和繁殖取得的内细胞群细胞,即可建立胚胎干细胞系[10][11]。目前胚胎干细胞的分离方法已有了一定的改进,比如现在已有使用激光去除透明带的技术[5]:5。
获取胚胎干细胞的成功率相当低,即使成功取得胚胎干细胞,维持其不分化的状态也十分困难。为了阻止胚胎干细胞在培养过程中分化,培养基需加入如白血病抑制因子(LIF)等因子。最初,胚胎干细胞需要在含有喂养层细胞的培养基上培养。喂养层细胞能为胚胎干细胞提供特定的微环境,以抑制胚胎干细胞的分化。喂养层细胞常常使用经过有丝分裂阻断剂(如丝裂霉素)处理过的胚胎成纤维细胞[8]。目前已能在成份清楚、无异物、不含有血清以及喂养层细胞的培养基上培养胚胎干细胞[5]:5。
Remove ads
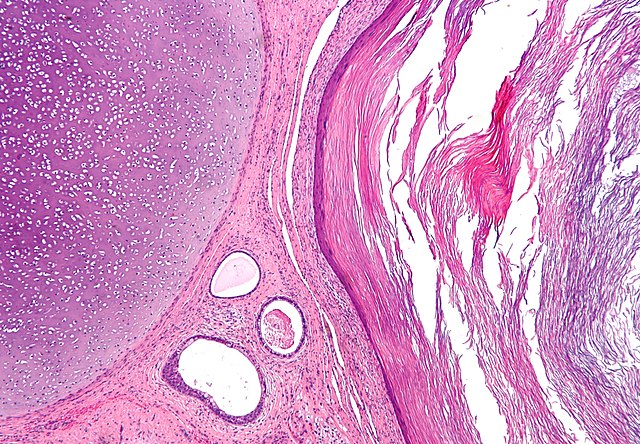
胚胎干细胞可以通过细胞集落或细胞本身的形态初步鉴定;除此之外,还可以从分子标记和分化潜能等两方面对胚胎干细胞进行鉴定[5]:8。
各基因的表达情况随细胞不同而异。因此,可以用一些在细胞中特异性表达的蛋白质对胚胎干细胞进行鉴定。上述特异性表达的蛋白质又分为两种类型:细胞内的蛋白质以及细胞表面特异性的蛋白质(细胞表面标记)。目前较常用的细胞表面标记有SSEA-3、SSEA-4、TRA-1-60和TRA-1-81(前两者为阶段特异性胚胎表面抗原,后两者为肿瘤识别抗原);而常选为分子标记的细胞内蛋白质则有Oct4和Nanog等。免疫组织化学技术利用能与这些分子标记特异性结合的抗体来鉴定胚胎干细胞,此外,这种技术也能与流式细胞分选术、免疫磁珠等方法结合,用于胚胎干细胞的分离[12][13][5]:8。
特异性分子标记的筛选可以采用转录组学与蛋白质组学的技术,将胚胎干细胞与其他细胞比对,以筛选出在胚胎干细胞中特异性表达的蛋白质[12]。
检验分化潜能也可以达到鉴定胚胎干细胞的目的。例如将小鼠的胚胎干细胞注射入其他的小鼠胚胎中,再使这个胚胎发育为完整个体,如果注射的胚胎干细胞具有多能性,最后就能形成嵌合体(即该小鼠的一部分细胞基因型与其他部分不同,该部分细胞来自注射的胚胎干细胞)。但是,考量伦理等方面的议题,上述方法并不适用于人类等动物。鉴定人胚胎干细胞的分化潜能主要有两种方法:体外培养形成拟胚体(embryoid body,EB)或注射入小鼠体内形成畸胎瘤。在体外低黏附性培养皿上培养人胚胎干细胞(或者悬浮培养人胚胎干细胞)能使胚胎干细胞形成一种特殊的结构,称为拟胚体,形成拟胚体的胚胎干细胞会分化为三大类分别具有外胚层、中胚层、内胚层细胞特征的细胞,利用不同的分子标记即可鉴定这三个胚层的细胞。如果将人胚胎干细胞注射入小鼠体内,则可以观察到畸胎瘤的形成,畸胎瘤的一些特征与早期胚胎相似,含有三大类分别具外胚层、中胚层、内胚层细胞特征的细胞[5]:8-12。
Remove ads
历史
1964年,刘易斯·克莱因史密斯(Lewis Kleinsmith)和巴里·皮尔斯(G. Barry Pierce Jr.)从畸胎瘤(一种生殖细胞病变后形成的肿瘤)中分离出了一种细胞[14],这种细胞拥有生长和分裂的能力,现在称这种细胞为胚胎肿瘤细胞(embryonal carcinoma cells,EC cells)[15]。胚胎肿瘤细胞形态与后来发现的胚胎干细胞相似,而且也具有多能性,因此过去曾作为小鼠的早期发育研究模式。但实际上这类细胞并不是十分理想的研究模型[16]。

1981年,英国剑桥大学遗传学部两个分别由马丁·埃文斯以及马修·考夫曼(Matthew Kaufman)领导的研究团队分别独立在体外建立了小鼠胚胎干细胞系,他们的论文于当年7月发表[1]。而“胚胎干细胞”这一术语最早则由加州大学三藩市分校(UCSF)解剖学部的盖尔·马丁(Gail R. Martin)教授于当年12月的一篇论文中提出[2]。她证明胚胎可以在体外培养,而且可以从中分离出胚胎干细胞。1989年,马里奥·卡佩奇、马丁·埃文斯和奥利弗·史密斯三人对胚胎干细胞使用基因工程技术,制造出了第一只基因敲除小鼠。1998年,威斯康星大学教授詹姆斯·汤姆森(James Thomson)等人成功建立了人胚胎干细胞系,为胚胎干细胞研究的又一突破[17]。
2006年,日本京都大学的山中伸弥课题组发表了一种方法,借由导入四个外源性基因(Oct3/4、Sox2、c-Myc、Klf4)诱导体细胞转化为人工诱导多能干细胞(iPSC)。iPSC比胚胎干细胞多了许多优势——iPSC在分化潜能、形态学等方面与胚胎干细胞的性质相似,但涉及的伦理道德争议较小,且可产生与个人基因型相同的多能干细胞[18]。
Remove ads
2009年1月23日,美国食品药品监督管理局(FDA)批准了一项I期临床试验,该试验将分化自胚胎干细胞的寡突胶细胞(oligodendrocyte,一种中枢神经系统中的细胞)移植入脊髓损伤的患者体内。这是世界首例应用人胚胎干细胞的临床实验[19],该项研究由加州大学尔湾分校(UCI)的汉斯‧柯尔斯特德(Hans Keirstead)及他的同事们主持,迈克尔·D·维斯特博士(Michael D. West, Ph.D)创立的加州门洛帕克杰龙公司(Geron Corporation)为这项研究提供资助。此前用大鼠进行的研究表明,脊髓损伤的大鼠接受由人胚胎干细胞分化成的寡突胶细胞移植7天后,运动能力得到了一定恢复[20]。这一疗法的I期临床试验计画征募8到10名截瘫病人,他们都是在试验开始前两周以内受伤的,因为细胞需要在瘢痕组织开始生长前注射。研究者强调,即使注射了这种细胞,基本上也不可能完全恢复病人的运动能力。该阶段的试验旨在测试该疗法的安全性,如果进展顺利,下一步他们将会让病情更严重的患者试用这一疗法[21]。2009年8月,FDA下令暂停这项试验,因为一部分接受这种疗法的大鼠在显微镜下观察到长出了囊肿。2010年7月30日,这项研究获许继续进行。2010年10月,研究者在亚特兰大的牧者中心(Shepherd Center)对第一名病人施行了该疗法[22]。2011年11月,杰龙公司宣布因为财政上的原因,暂停这项研究以及相关试验,但会继续观察已接受治疗的患者。同时,他们希望能够找到合作伙伴以继续这项研究[23]。2013年,由迈克尔D.维斯特博士领导并继承所有杰龙公司干细胞资产的BioTime公司,宣布重启此前杰龙公司暂停的临床研究[24]。
Remove ads
应用前景、法律法规与挑战

胚胎干细胞具有相当大的分化潜能,这使得胚胎干细胞可以分化为人体的各种细胞、组织,乃至器官。这使得胚胎干细胞在组织工程与再生医学领域拥有巨大的应用前景[25]。另外,胚胎干细胞也是发育生物学研究以及药物试验的良好材料,利用胚胎干细胞技术产生的基因敲除小鼠、转基因小鼠对生物医学研究也有重要作用[5]:3-5。但是,胚胎干细胞本身存在的一些缺陷(比如,难以产生与接受者基因型完全相同的胚胎干细胞,使得可能对生成的细胞发生排异反应),以及伦理、道德、法律等方面的争议,使得胚胎干细胞的研究仍面临着一定的挑战。另外,山中伸弥等发明的iPSC技术相比胚胎干细胞在伦理等方面拥有优势,对胚胎干细胞的地位亦产生了一定的冲击[6][26]。
胚胎干细胞最受关注的潜在用途是它能应用于细胞替代疗法(cell replacement therapies,CRT)中。即通过将胚胎干细胞诱导分化为心肌细胞、神经元、肝细胞、骨髓细胞、胰岛细胞和内皮细胞等,再利用这些细胞替换或补充患者体内死亡或丧失功能的细胞[27]。研究人员已能够诱导胚胎干细胞分化为NK细胞和骨髓组织[28]。另外,研究人员已经能诱导胚胎干细胞分化为产生胰岛素的细胞。这为糖尿病的治疗带来了希望[29]。亦有研究者试图诱导胚胎干细胞分化为产生多巴胺的细胞,以治疗帕金森综合症[30][31]。目前,使用胚胎干细胞的细胞替代疗法主要面临的挑战有:如何克服因基因型不同而可能产生的免疫排异反应、如何产生足够数量的细胞、如何诱导干细胞产生一个完整的器官、植入后的细胞、组织或器官如何与周围的组织融合,以及如何剔除未分化的干细胞,以免这些细胞一同移入患者体内,形成肿瘤[32]。
另外,胚胎干细胞亦可以用于干细胞治疗中。例如,利用基因工程技术将特定具有治疗效果的基因导入胚胎干细胞中,再诱导这些胚胎干细胞分化为目标细胞。再将这些工程细胞导入患者体内,可达到治疗疾病的目的[32]。胚胎干细胞使用比体细胞更高效的DNA修复手段,因而相比体细胞,其基因突变率要低得多,这使胚胎干细胞还有潜力用于DNA损伤的修复[33]。
胚胎干细胞良好的分化、增殖潜能使其成为药物安全性以及药效试验的良好材料[34]。目前,已经有使用胚胎干细胞分化而成的心肌细胞测试药物对心脏毒性的案例[35]。未分化的胚胎干细胞也可以用于药物对发育毒性等的药物毒理研究[34][36]。
Remove ads

胚胎干细胞研究,尤其是人胚胎干细胞的研究常常会引起伦理、道德以及法律上的争议,大部分国家和地区都对胚胎干细胞研究施加了一定的限制,惟限制的程度不尽相同[37][38]。
日本、南韩、以色列、伊朗、印度、中国大陆、台湾对人胚胎干细胞研究限制较少,且对相关研究予以支持。其中,中国大陆对胚胎干细胞研究的限制尤其少[37][38]。
大部分南美洲国家(除巴西[39])、非洲国家(除南非[40])都对胚胎干细胞研究施加较大的限制[38]。
大洋洲的澳大利亚对人胚胎干细胞研究限制较少,但新西兰对相关研究的限制则相对较大[41]。
欧盟内部的国家对干细胞研究的态度截然不同。瑞典、芬兰、比利时、希腊、英国、丹麦和荷兰等国目前允许人类胚胎干细胞的研究(其中英国对胚胎干细胞研究的限制尤其少),但这类研究在德国、奥地利、爱尔兰、意大利和葡萄牙等国却仍然是非法的[38]。
美国没有任何联邦法律约束人类胚胎干细胞研究。但是,由联邦资助的研究会受到一定程度的限制。根据时任美国总统乔治·布什于2001年签署的法案,只有于2001年前建立的胚胎干细胞系(根据这一法案,实际上符合条件的细胞系只有21种)可以用于联邦资助的研究中。后来巴拉克·欧巴马总统于2009年废除禁令,但随后通过的一项修正案禁止联邦法案资助会毁坏人类胚胎的研究,也就意味着新的胚胎干细胞系无法通过联邦资助的研究获取。也就是说,联邦资助的研究可以使用任何已存在的胚胎干细胞系,但不能在研究中新建胚胎干细胞系[42]。美国各州对胚胎干细胞研究的态度也截然不同,部分州完全禁止胚胎干细胞的研究,比如阿肯色州、印第安纳州、路易斯安那州、密歇根州、北达科他州和南达科他州[43]。另外一部分州则会给予相关项目资金资助,比如加利福尼亚州[38]。
Remove ads
胚胎干细胞一直是科学界与宗教组织争议的热点问题之一[44]。另外,胚胎干细胞研究的合法性在法理学、伦理学等领域也是一个惹人注目的焦点[45][46]。相关争议在世界上绝大部分国家和地区都存在。其中,美国作为世界上生物医学研究水平最高的国家,关于胚胎干细胞的伦理、宗教、法律争议尤为激烈[47]。
取得人胚胎干细胞必然要破坏人类的胚胎。而基督教的主流观点一直认为生命从卵细胞受精就开始了,人无权剥夺胚胎的生命,因此,基督教以及部分支持基督教的组织一直是堕胎和人胚胎研究的反对者[48][49][50]。部分学者认为这也违反了儒家的“仁”并犯了佛家业报[51]。伊斯兰教对胚胎干细胞研究(治疗性克隆)的态度相对基督教等宗教温和。根据伊斯兰教义,毁坏神圣的胚胎是一种罪行,但是毁坏得到灵魂前的胚胎(胚胎得到灵魂的时间是受精4个月后)罪过较轻。在伊朗、埃及等伊斯兰教国家,人胚胎干细胞研究是合法的,但仍有一部分穆斯林反对胚胎干细胞研究或对此表示担忧,大部分伊斯兰教国家未对人胚胎干细胞研究进行立法[52][53]。
政治上,部分保守派反对胚胎干细胞的研究。比如,反对胚胎干细胞研究的前美国总统小布殊就曾经说(关于人的)胚胎干细胞研究“跨越了我们这个社会所应尊重的道德底线”[44][37]。科学研究者,尤其是生物医学领域的研究者,则对胚胎研究多持支持态度。比如,曾经有33名诺贝尔奖得主在他们写给美国国会的一封公开信中这样说:“那些试图阻止干细胞带来的医疗进步的人要对那些饱受可怕疾病折磨的病人和他们的家人负道义上的责任……”[54][47]。另外,有科学家[55]这样说:“一个仅仅发育了6到7天的早期胚胎,还不能说是一个‘人’。它的神经组织远未发育,没有知觉,更没有意识,谈不上需要我们的尊重。而解除千千万万病人的痛苦,拯救他们宝贵的生命,才是对人类生命的最高尊重。”有英国科学家提出:“细胞研究可以使一些疾病提早5至10年攻克,禁止这项研究反倒不负责任且不道德。”[54]但是,也有部分具有天主教背景的科学家反对胚胎干细胞的研究,比如美国科学家,斯坦福大学细胞生物学博士特里萨·戴谢尔。她是2009年起诉美国政府允许联邦资金资助胚胎干细胞研究的法案的两名原告之一[56][57]。围绕胚胎干细胞研究的法学讨论主要围绕早期胚胎是否具有“人”的权利展开[46][45]。
参见
参考
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads
