热门问题
时间线
聊天
视角
艾滋病
艾滋病毒感染引起的人類疾病 来自维基百科,自由的百科全书
Remove ads
获得性免疫缺陷综合征(英语:acquired immunodeficiency syndrome),通称艾滋病(AIDS)[注 1],ICD-11称人类免疫缺陷病毒病[注 2](human immunodeficiency virus disease)[12],是一种由人类免疫缺乏病毒(HIV)感染造成的疾病[13][14][15][16]。目前,该病尚无有效的治疗方法,人们一旦感染艾滋病毒,就会终生携带,但通过妥善治疗,艾滋病毒可得到控制[17]。
HIV以人体的免疫系统作为攻击目标,在没有任何治疗手段介入的情况下,艾滋病感染者的免疫系统将逐渐被HIV摧毁,直至丧失几乎所有免疫能力。
临床上一般将艾滋病分为四个阶段:急性感染期、潜伏期、症状期,以及典型AIDS发病期[注 3]。在HIV的急性感染期,大部分感染者不会出现明显症状,但也有部分感染者出现类似流感的症状[18]。HIV急性感染阶段后,艾滋病进入潜伏期,这一时期感染者仍然不会出现明显症状[19]。艾滋病的潜伏期长度介于数月到20年之间。根据统计,艾滋病潜伏期的平均长度大约是10年[20][21]。最后,HIV感染者的免疫系统几乎被HIV摧毁。艾滋病进入症状期会几乎失去所有免疫力的患者将很快死于感染或恶性肿瘤[19]。一般将病程处于急性感染期与潜伏期的感染者称为“HIV携带者”,而将进入症状期(发病期)的感染者称为“艾滋病人”。
HIV以人体免疫系统中的CD4+ T细胞(辅助性T细胞,Th)为攻击目标。在急性感染阶段,HIV通过gp41与gp120组成的复合体侵入CD4+ T细胞,导致CD4+ T细胞的数量开始下降。侦测到HIV存在的免疫系统很快会作出反应,杀死大部分的HIV,令CD4+ T细胞的数量几乎恢复到正常水平。但HIV病毒通过高频率的突变,最后能逃过免疫系统的追捕,转为潜伏状态。在HIV处于潜伏状态的潜伏期,CD4+ T细胞的数量持续下降。最后,当CD4+ T细胞数量下降到极低水平、HIV病毒上升到一定水平后,艾滋病也随之进入症状期。没有CD4+ T细胞辅助的后天免疫系统几乎失灵,免疫系统将难以杀灭侵入机体的病原体以及体内发生癌变的细胞,患者很快就会死于感染或恶性肿瘤。[22]
引发艾滋病的HIV是一种逆转录病毒。HIV暴露在空气中之后会在几秒钟到几分钟之内全部死亡。艾滋病的主要传播方式包括血液传播、母婴传播,以及性传播。一些体液,如唾液、汗液和泪液,不会传播HIV。[23][23]
20世纪初期至中期,在非洲中西部,HIV由其他灵长类动物传给人类[24]。1981年,美国确认了首例艾滋病感染者[25]。艾滋病作为一种广泛传播的传染病,其流行状况在发展中国家尤其不乐观。至今艾滋病的传播仍未受到有效控制[26]。据世界卫生组织统计,截至2021年[update],全世界约有3840万人携带艾滋病毒,2021年度新增感染者约150万人、死亡约65万人[27],其中,有约2,060万名HIV感染者生活在东部和南部非洲[28]。自艾滋病毒流行以来截至2021年12月[update],已有约8,420万人感染艾滋病毒,约4,010万人死于艾滋病相关疾病[29]。艾滋病是人类历史上致死人数最多的流行病之一[30]。
艾滋病作为一种疾病以及以及许多歧视的根源,对社会产生了巨大影响。[31]艾滋病也有很大的经济影响。[31]人们对艾滋病有很多误解,例如认为它可以通过偶然的非性接触传播。[32]艾滋病已经成为许多涉及宗教的争议的对象,包括天主教会不支持用安全套预防艾滋病的立场。[33]自20世纪80年代被发现以来,它已经吸引了国际医学和政治上的关注,以及大规模的资金。[34]
目前,随着抗艾滋病药物的发展,在得到妥善治疗的前提下,艾滋病感染者的预期生存期已得到很大程度的延长。目前的治疗方案能将艾滋病毒的数量控制在很低水平。根据估计,如果一个20岁的青年人在1996年患上艾滋病,他只能活到大约39岁。如果一个同样的20岁青年在2011年患上艾滋病,他可以活到大约70岁。[35]
Remove ads
历史



无数据
≤ 10
10–25
25–50
50–100
100–500
500–1000
1000–2500
2500–5000
5000–7500
7500-10000
10000-50000
≥ 50000
经溯源研究,发现爱滋病毒最早出现在约1920年代的非洲比属刚果金沙萨,由西非中部的黑猩猩传给人类,后来爱滋病毒由此处开始蔓延全球。[36][37][38]
1981年5月18日,同性恋报纸《New York Native》首次报道了具有艾滋病症状的病例,不过该报纸没有确认他们患有的疾病是艾滋病[39][40]。1981年6月5日,美国疾病控制与预防中心通报全球首5宗爱滋病毒感染案例[41][42],这5起病例是一群毒品注射者和男同性恋者,当时医学界没有弄清他们免疫力受损的原因,但这5例患者都出现了耶氏肺孢子虫肺炎患者才有的症状[43]。此后不久,又有大量的同性恋男性患上了一种罕见的皮肤癌,即卡波西肉瘤[44][45]。随著更多的耶氏肺孢子虫肺炎和卡波西肉瘤病例的出现,使得美国疾病控制与预防中心有所警觉,他们为此特地成立了一个工作小组来监测疫情[46]。自此人类便展开了与这头号传染病的漫长抗争。在爱滋病发现之初,医学界对其了解甚少,苦无医治对策,染病者只好受折磨至死。直至1995年终首现曙光,鸡尾酒疗法的发明与广泛应用均延缓了大多数感染者的发病时间,使死亡率开始大幅下降。及至2010年代,科学家仍在进行大量研究与临床实验,以尽快找出彻底根治的方法。多数学者认为人类免疫缺乏病毒是20世纪从撒哈拉以南的非洲地区蔓延开来,至今已成为全球性的大流行病。[47]
而艾滋病在2005年造成约300万人死亡,当中约57万是儿童,三分之一的死亡案例发生在非洲撒哈拉以南,间接造成经济发展迟缓以及人力资本的匮乏,超越了疾病本身的层次,后天免疫缺乏症候群使得社会议题更加棘手[48]。根据统计,每天有1,800名新生儿一出生就感染上艾滋病毒,45%的感染儿童在2岁之前死亡。尽管目前研制的药物能够抑制病毒的活性及减缓病程发展,间接减少感染后的死亡率和发病率,但副作用及局限仍很明显,且并非所有国家都有能力取得这些药物,这种情况在发展中国家更为严重,当地却同时是后天免疫缺乏症候群患病率较严重的地区[49],且事实上仍未有任何药物获得证实能根治爱滋病,因此爱滋病目前已是全世界公共卫生监测的重要指标之一,各国政府也透过立法试图控制传染的规模,并借由各种教育宣传手段,增加全人类对该疾病的认识。
HIV分为两种:HIV-1型与HIV-2型。
HIV-1型依病毒演化分析分为M(major)group、N(non-M, non-O)group及O(outlier)group。其中的M group病毒已遍布世界而造成全球性流行病毒。而N group及O group则相当少见,多见于中西非,美国及欧洲则有少数案例,亚洲尚未发现。若深入分析,可发现HIV-1型的次亚型共有10种之多,分别为M group的(A, B, C, D, F, G, H, J, K)与流行重组型(circulating recombinant forms,CRFs)组成。HIV-2型由于病毒效价较低及水平和垂直感染的比率较低,目前仅流行于西非,因此HIV-1型的毒性与传染性均高于HIV-2。[50]
HIV-1型和其它在很多灵长类动物中发生的引起类似艾滋病的病毒有密切关系,并曾一度被认为是在二十世纪初期从动物传染给人类的,尽管有一些证据表明在更早的一些个别案例中可能已经有艾滋病在传播了。但是传播的具体动物源、时间和地点(或者有多少传播来源)都是未知的。与人类相同的HIV在非洲的小人猿(黑猩猩)中都有发现,但这并不能证明人类身上的HIV最早来源于黑猩猩,或人类和黑猩猩的HIV是从第三方获得的。
2007年与2008年,“柏林病人”蒂莫西·雷·布朗在接受两次骨髓移植与干细胞移植后[51],其体内的艾滋病毒被免疫系统清除,而被认定为全球首位艾滋病痊愈患者[52]。2016年,“伦敦病人”亚当・卡斯蒂列霍亦经成体干细胞移植后被治愈,被认定为全球第二位艾滋病痊愈患者[53]。2022年2月,据《细胞》期刊载,一位混血女性于2017年8月接受脐带血移植后,在停止抗反转录病毒药物治疗后的14个月内未发生艾滋病毒反弹[52][54][55][56],即“纽约病人”。2022年7月27日,美国希望之城国家癌症中心宣布了一名66岁的患者被“治愈”。2023年2月,据《自然-医学》期刊载,罹患HIV-1型的杜塞尔多夫患者于2013年移植了和“柏林病人”、“伦敦病人”一样的同种异体造血干细胞CCR5Δ32/Δ32后被治愈,其中断抗反转录病毒药物治疗的四年后,未出现病毒反弹[57][58]。
截至2023年2月[update],全球仅有五位艾滋病患者被确诊治愈[59][60],同时,2021年全球有150万人新感染艾滋病毒,约有3,840万人感染艾滋病毒,其中3,670万人是成年人,170万人是小于15岁的儿童,妇女和女童占比54%。2021年全年,全世界约有65万人死于艾滋病相关疾病,2004年该数字为200万人,2010年为140万人[61]。截至2021年年底,全球有2,870万HIV感染者 (75%) 正在接受抗逆转录病毒疗法[61]。自艾滋病流行以来,已有约4,010万人死于艾滋病相关疾病[29]。
Remove ads
病因
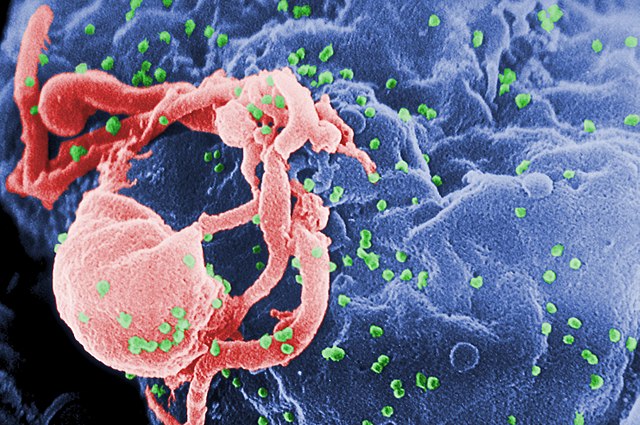
普遍认为,人类免疫缺陷病毒的感染导致艾滋病,人类免疫缺陷病毒通常也俗称为“艾滋病病毒”或“艾滋病毒”,艾滋病是后天性细胞免疫功能出现缺陷而导致严重随机感染及/或继发肿瘤并致命的一种疾病。
人类免疫缺陷病毒属于一种反转录病毒,主要针对人类免疫系统重要的组成进行感染并改变其运作模式,包括辅助型T细胞、巨噬细胞、和树突细胞等,其中又以直接破坏细胞膜上具有CD4辨识蛋白特征的T细胞(简写作CD4+T细胞)的结果最为严重,因为CD4+T细胞是人体免疫系统辨识外来物质过程中,不可或缺的元素之一,一旦CD4+T细胞受到感染而不表现CD4辨识蛋白,或甚至造成此种细胞死亡,导致每微升血液中CD4+T细胞数量低于200时,细胞免疫就几乎完全失去功能,进而导致平时不易感染健康人类的微生物得以大肆入侵。
由于受HIV感染个体无法有效分辨敌我,最后导致严重的各种感染症,总称后天免疫缺乏症候群[62]。后天免疫缺乏症候群患者所遭遇严重的病理呈现,主要源自于人类免疫缺乏病毒的感染。
根据流行病学统计,在未使用抗反转录病毒药物治疗的情况下,自感染病毒至出现症状的潜伏过程的中位数约为9至10年,自正式出现后天免疫缺乏症候群起算,存活时间的中位数亦仅有9.2个月[63]然而,临床观察到的疾病进程速度受到许多因素影响,在个体之间有很大的变异,短则两周、长可达20年。这些因素甚至也包含了爱滋病毒所攻击的免疫系统总体状况,因此从感染开始到发病,甚至其变化程度,都一直受到感染者免疫力和病毒活动之间的互动所影响[64][65]。举例而言,一般年长者免疫力较差,因此相对于年轻患者而言,病程发展迅速的风险较高;医疗的品质和同时存在的感染症(如结核)也会使得HIV感染者处于较为不利的状态[63][66][67]。
此外,遗传也左右了感染过程和感染后的状况,有些人因带有编号为CCR5-Δ32的突变基因,对特定的HIV株具有抵抗力[68]。更有研究指出,罗马帝国子民后代更易感染HIV:在西班牙、意大利和希腊这些长期处于罗马帝国核心的地方,他们的CCR5-Δ32基因出现率为0%-6%。而在罗马帝国边疆地区、比如英格兰和德国,这种基因出现率则是8%-11%。那些从来没有被罗马占领过的国家,CCR5-Δ32基因出现率更高。该基因变异的频繁度,正与古罗马版图的变迁吻合[69]。此外,由于HIV本身在演化过程中亦会产生变异,不同品系也可引起不同程度的临床表现,一般患者会发热,头痛以及后颈痛得像被火烧一样等感觉[70][71][72]。
Remove ads
诊断

爱滋病毒属滤过性病毒,由于其体积极为微小,现有的检测方法不能准确检出病毒存在,但身体会自然产生抗体对抗病毒,抗体增长在一段期间后将达至可被验出的程度,这段期间称为空窗期(或窗口期),由11天[73](最快)至三个月不等,亦有个别例子长达六个月,世卫及多数国家政府则采用三个月为准。在空窗期间接受爱滋抗体测试,有机会呈假阴性反应,因此必须等待怀疑受感染日起计最少三个月后接受测试,才可得出较准确结果。亦有少数发达国家(如日本)采用抗原抗体联合检测方法并规定此方法的空窗期为两个月(60日)。爱滋病毒抗体测试一般以抽取血液为主,有个别机构则采用尿液样本化验。以往,血液测试报告需等候一天至数天不等,自从民间团体引入新兴的快速测试后,爱滋抗体血液结果缩短至几分钟至十多分钟不等。除到指定政府机构、民间志愿团体或私立化验所接受爱滋病抗体测试外,亦可自行到医疗网站订购价钱大众化的爱滋病自我检测器。若测试结果证实为阳性,则必须尽快到政府爱滋病专科就诊及定时服药。[来源请求]
自1981年发现爱滋病以来,流行病学专家曾提出各种不同的定义,以监测疾病扩散情况,例如1985年的班基定义和1994年世卫爱滋病例扩充定义,然而临床上对病人的分级诊断却因为该定义的检测效果不佳,因而未能大量采用。在发展中国家,世界卫生组织采用临床表现和实验数据作为分级依据,而在已开发国家中,则主要采用美国的分类系统。
病程与表现

CD4+ T 细胞计数 (每 μL 细胞)
HIV RNA 拷贝数(每毫升血浆)
若以伺机性感染而言,肺囊虫肺炎、隐球菌性脑膜炎、肺结核、沙门氏菌感染等比较常见;若以症状来看,其体重减轻、慢性咳嗽、慢性腹泻是常见的症状。
爱滋病病毒进入人体后,会在24-48小时内到达局部淋巴结,约5天左右在外周血中可以检测到病毒[76]。感染后1周内,最早受感染的细胞在局部增殖,使病毒进一步扩散、感染次级淋巴器官[75]。感染第2周时,血液和组织中的病毒复制达到高峰,在感染后4周,血浆病毒载量下降到一个相对稳定水平[77]。
病毒在快速繁殖期间,每毫升血液中的病毒含量可达数百万,同时CD4+细胞数量也会显著下降。随后,CD8+细胞开始活动,杀死被感染的细胞,免疫系统也开始产生抵抗艾滋病病毒的抗体。CD8+细胞的活动被认为是控制病毒水平的要素之一。如果它们反应强劲,就可以延缓病程,但是并不能清除所有病毒。CD8+细胞活动逐渐减弱消失后,CD4+细胞的水平也恢复到每微升800左右(正常值是1200左右)。在这个阶段(通常是感染后的2~4周),大多数病例都会产生类似流感或者单核血球增多症的病症,这被称作急性HIV感染。常见的症状包括发烧,淋巴结病症,咽炎,皮疹,肌肉疼痛,疲乏,口腔溃疡,还可能包括头痛,恶心,呕吐,腹泻,肝/脾肿大,体重下降,鹅口疮,神经系统病变等。每个病例的具体症状各有不同,每种症状是否发生皆有可能。这些症状的持续时间平均约28天,通常至少要有一周。因为这些症状没有特异性,所以经常未被认为是感染了艾滋病病毒的征兆。甚至病人就医时医生亦可能误诊为有相似症状的,其他更常见传染病。因此,这些症状并不能作为确诊艾滋病病毒感染的依据。但是遇到这些症状时仍然需要格外小心。因为病人此时血液中的病毒含量很高,他们的传染性非常强。而通常发热、周身不适症状等出现后5周左右,血清HIV抗体可呈现阳性反应[75]。

爱滋病急性期症状至少高危行为后的第三天才会有部分出现,而这种症状不会发生在高危的10周以后,绝大部分人出现急性症状的时间是在10-14天,持续时间1到2周,而需要知道的是有50%以上的艾滋病感染者初期是不出现急性期症状的。
艾滋病感染者出现初期症状的比例:
Remove ads
免疫系统的强烈反应抑制病毒活动,并能减少血液中的病毒数量。在临床潜伏期内,感染者可以没有任何临床症状,但潜伏期内病毒不是静止的,也不是人体的安全期,病毒会在人体内持续复制,不断破坏免疫细胞[75]。潜伏期的长度受很多因素的影响,从2年[75]、3年[78]到最长可达20年[79],平均约8年[80]。在临床潜伏期的早期,病毒通常藏身于淋巴结内。由于CD4+细胞是艾滋病病毒的主要靶细胞之一,同时亦在免疫系统中占有关键地位,因此除了病毒含量,CD4+细胞数也是监测病程的重要指标。通常一旦每微升血液中的CD4+细胞数少于200时,或者CD4+细胞在淋巴细胞中所占比例少于14%时,细胞免疫机能已经难以维持,病人即将进入艾滋病前期。
病人出现腹股沟淋巴结以外的两处以上不明原因的淋巴结肿大持续3个月以上,并出现全身症状,如无故发热、疲劳、食欲不振、消瘦、体重下降、睡眠时冒汗等症状。从潜伏期后开始出现艾滋病相关的症状和体征,意味着病人从潜伏期进入到艾滋病前期,对这一病程的症状与疾病有很多命名,包括“艾滋病相关综合症”、“淋巴结病相关综合症”、“持续性泛发性淋巴结病”、“艾滋病前综合症”等[75]。这一病程的病人已具备了艾滋病最基本特点,即细胞免疫缺陷,只是症状较轻而已[75]。

这一病期又被称为致死性艾滋病,是艾滋病病毒感染的最终阶段,此时病人的CD4+T淋巴细胞计数明显下降,少于200个/µL,HIV血浆病毒载量明显升高[75]。突出表现为致病性感染,其中包括原虫、真菌、病毒、细菌感染,恶性肿瘤的发生等,根据香港卫生署的数字显示[81],最常见可被界定为爱滋病发的并发症依次序为肺囊虫肺炎、结核病、真菌感染、马尔尼菲青霉菌、卡波西氏肉瘤、分枝杆菌、巨细胞病毒等。进入这阶段的病人一般不会存活超过九个月,然而医学的进步,存活的时间也可能延长。

预防
艾滋病毒其实脆弱,一旦暴露于空气中(离开人体)便会很快死亡,因此艾滋病可以通过下面的措施来部分预防。已知的艾滋病感染途径就是体液交换及没有全程正确使用安全套。带有艾滋病血液(针筒上的血液)在空气中不能立即死亡,浓度愈高生存时间愈长,长的则可达三日,即使浸在酒精消毒也能生存十分钟。
艾滋病的主要传播途径有血液传播、母婴传播及性传播,因此可通过下列途径预防艾滋病:
- 安全性行为:除了高度可信的性伴侣外,在所有的性行为中使用安全套;除非能确定对方没有患病,否则没有全程正确使用保险套的性交和肛交是一种高危险行为(精液中病毒高,许多病患会以为吃药就没有传染性,但至少也要确认血液病毒量长期维持在极低状态,此时也只是代表无套性交的感染率下降,并非不会感染)。少数人与艾滋病感染者口交而透过伤口被感染,但这种方式通常被认为是低风险的。但是,无论如何,如果希望绝对的安全,在口交中也应当使用安全套。唾液的艾滋病毒浓度很低,接吻是不会感染艾滋病,除非对方口腔有伤口。
- 包皮环切术:大量科学研究证实了男性接受包皮环切术可使自身感染艾滋病毒的风险降低约60%[90][91][92]。
- 慎选性伴侣,安全性伴侣极为重要,双方皆终身单一性伴侣风险最低,使用酒精毒品的社交环境及杂交风险最高;由于保险套会显著的降低性交时男方的快感,因此偷拔保险套是很常见的,另外,许多爱滋病患也会感染其他性病,而其中有一部份是保险套无法完全预防的;而一夜情及杂交风险极高又多了“对方假装自己没有性病”的风险,避开使用酒精毒品的社交环境是自保的基本常识、这会让人降低警觉性、造成危险甚至不愿意的性行为;选择忠诚性伴侣也可以有效降低危险性。
- 不要共用针筒及稀释液,也不要使用已经被人使用过的针筒及稀释液。注射毒品使用共用针头可能导致传染。
- 医护工作者遵循了安全措施就可以避免艾滋病在病人和工作人员间、病人之间的传播。通过针刺感染艾滋病的比率少于1比200。在职业暴露后一定时间(48小时)内口服阻断药物可以进一步减轻被感染的风险。在侵入性医疗及急救中,让医护及急救人员知道患者是否为爱滋病患对预防感染也很重要,因为应对爱滋病等级的安全防护及曝露后投药成本高、对医护人员身心负担很大,不可能对每个病患都实施(消毒等级更高、暴露后投药的副作用常强到让人失去工作能力)。另外,即便是非侵入性医疗,医师的知情与否常常是治疗成败的主因,因为病患必须因为爱滋病而改变医疗策略及调整药物。
- 暴露前预防:前提是未感染方正确的采用预防性投药,而感染方则正确服药、且血液病毒量控制到极低;则传染性稍低于保险套。但成本高、服药麻烦、副作用会让许多人无法忍受,而且许多爱滋病患同时患有其他性病;因此无法跟避孕药一样可靠及普及。
- 疫苗:尽管目前来说对于艾滋病的防治没有有效的疫苗,2009年发布的RV144单次试验疫苗被发现能够减小接近30%的患病机率。这也促使科研人员坚定对研究出真正能够防治艾滋病疫苗的信心。对于RV144等疫苗的试验都显示效果不佳、无法上市。
- 不要轻忽鸡尾酒疗法的副作用及局限性,不要高估药物对传染力的抑制力,不要轻忽一些爱滋病患的报复或轻忽行为带来的风险,不要忘记许多爱滋病患同时患有其他性病:虽然说对爱滋病的治疗已经达到只会小幅减损寿命的程度,但鸡尾酒疗法的副作用及局限性仍然造成生活品质的明显下降及明显的痛苦;而且许多病患看似健康无病,一些病患坚持对性伴侣(及一夜情对象)隐瞒病情及无套性交,就产生了大量的受害者。
基于以上,各国虽限制标准不一,但是有些地区会限制或禁止以下人士捐血标准。
- 在1977年(艾滋病发现大规模传播的大致开始时间)或以后曾与生于或居于喀麦隆、中非共和国、乍得、刚果、赤道几内亚、加篷、尼日尔或尼日利亚的人士有性行为。(HIV group O不易检验)
- 在1977年以后于撒哈拉以南非洲有活跃的性行为。
- 1988年之前接受血友病治疗。
- 高危险性行为
治疗
虽然对于爱滋病治疗投入了大量的资源研究,但医学界目前没有任何可以治愈爱滋病和人类免疫缺陷病毒(HIV)的方法,也没有可行的疫苗,多数研究突破也没办法成为正规疗法(药物研究成功率极低)。目前美国食品药品监督管理局(FDA)已批准二十多个药物用于AIDS的治疗,但所有的治疗方法都只能减慢或抑制病毒在体内的扩散[93],并不能有效地清除患者体内的人类免疫缺陷病毒(HIV),这些药物也不能将传染性降到极低,而且这些药物价格昂贵,且有较强的毒副作用,会诱发病毒耐药株的产生。

2011年9月,英国研究人员移除爱滋病毒外套膜内的胆固醇后,发现病毒失去攻击人体免疫系统的能力,人员估计可依循此方向,研究能预防病毒的疫苗。[94]
2013年5月,香港大学研究出一种新型疫苗,成功令带有爱滋病的小老鼠产生大量及有效针对爱滋病病毒的CD8+T细胞,以清除体内受病毒感染的细胞,并产生保护作用。此疫苗暂时只在老鼠身上进行实验,预计最快于5年后进行人体测试。[95]
2014年3月,华裔美籍爱滋病研究专家何大一,在《科学》杂志刊登的研究指出,其医学团队研发一种新的注射药物,在猕猴身上注射后,猕猴3个月内不受爱滋病毒入侵,为治疗爱滋病带来新的突破。新药有助减低高危人士感染爱滋病的机会,并指出未研发爱滋病疫苗前,注射新药物的方案可用于“中间的过渡期”。他又指药物需要每季注射一次才能保持效用,但目前仍未在人体身上进行试验,他们将与药厂在美国展开临床试验,预计2015年获得新药的安全数据,并计划于高危人士中展开类似临床研究。[96]
2020年,美国HVTN 702疫苗在泰国进行RV144临床试验三年多后宣布失败,实验结果是没有显著效果。[97][98]
2013年4月,距离根治爱滋病迈进一大步,丹麦研究人员使用抗癌特效药物“帕比司他”(Panobinostat)将爱滋病毒逼出去氧核糖核酸至细胞表面,人体免疫系统之后与特制疫苗联手合作,把爱滋病毒彻底消灭。现进行人体测试,若研发成功,爱滋病或因此正式从绝症名单中剔除。[99][100]然而在2014年的实验中证实,停止帕比司他投药后2-8周爱滋病毒将恢复运作,治愈爱滋的梦想暂时宣告失败。
美国于1981年发现新型疫症爱滋病之初,没有一种药物或疗法能有效降低死亡率,每年全球的死亡人数有增无减。但到1995年,华裔美籍科学家何大一博士发明了鸡尾酒疗法,虽然并非彻底根治,但成功大幅减低死亡率,将发病时间无限期推迟,也使感染者血液的病毒数可以降低至无法验出的状况,从而大幅改善带原者的健康、并降低其传染性,不过鸡尾酒疗法不但成本高昂、对忘记服药的忍受性低、许多感染者服药后会有严重的副作用、而且有明显的局限性(例如无法抑制慢性发炎而提早罹患老人病、服药后肠胃组织、大脑、生殖器官及精液仍有较高量的病毒、治疗后的传染风险仍高),医学界均认为艾滋病尚不能称之为可以治愈的疾病。
这项研发使何大一以“爱滋病研究者”(AIDS Researcher)的身分荣获1996年的《时代杂志》年度风云人物。
预防艾滋病的疫苗仍在研制中,但进展很慢。至今,还没有一种有效的治疗方法可以完全治愈艾滋病,每年仍有大量的病患死于艾滋病,特别是在缺乏有效疗法和药物的第三世界国家(如非洲)。现在昂贵的艾滋病治疗方法主要针对HIV,目前仍未证实在治愈方面有效。艾滋病发病期产生的各种机会感染,有些可以对症下药进行治疗,或者在感染发生前就进行预防性治疗,但也有些机会感染很难治疗。在台湾,亦为中央研究院院士的何大一,则与台大医院进行长期临床医疗研究,进一步与全台湾各教学级医院进行人体临床实验,以期加速进展台湾的HIV治疗现况。原鸡尾酒疗法需要至少每日一次且服用多颗的状况,已于2014年12月1日获得改善;台大医院、高雄荣民总医院皆已提供每日一次一颗的治疗方针。然而这仍非普遍性用法,主要在于新药虽以鸡尾酒疗法将多种药物合而为一,但与其他HIV药品一样,至少10年的研究尚未诞生,对于副作用的症状说明仍较模糊,无明确的叙述。
2005年11月,据英国广播公司及一些报章称:一名25岁的伦敦男性居民安德鲁·斯丁普森曾在2002年5月确诊感染艾滋病病毒,但未进行任何药物治疗,在2003年10月检查时发现病毒已经消失。但负责治疗斯廷普森的切尔西和威斯敏斯特全民保健系统基金仍要求斯廷普森接受进一步检查,他有可能是第一位自己痊愈的HIV感染者。[101][102]
另据美国媒体2008年11月12日报道,一名同时患有白血病和艾滋病的患者蒂莫西·雷·布朗在接受干细胞骨髓移植手术后,体内的HIV居然也全部消失了。蒂莫西·布朗早在1995年就感染爱滋病毒。治愈蒂莫西·布朗的吉罗·胡特是血液学专家,而非艾滋病专家。他在准备骨髓移植手术的过程中想起一篇论文,文中称一些人携带的一种让CCR5有缺陷的突变基因似乎能让他们先天具有抵御艾滋病病毒的能力,因为艾滋病毒进入免疫系统,必须同时结合免疫细胞表面的两种物质CD4和CCR5。这种自双亲遗传的基因称为“CCR5-Δ32”,能够阻碍艾滋病病毒对人体健康细胞的侵袭。吉罗·胡特便开始寻找携带这种基因、且能与患者骨髓相配型的捐献者。结果在80名骨髓配型成功的捐献者中,第61人被检测出带有“CCR5-Δ32”突变基因。找到合适的配型者后,患者还在医生的指导下做了一系列准备。他服用了一些效力强劲的药物,接受了放射性治疗,目的在于消灭其自身受到感染的骨髓细胞,使其免疫系统丧失功能。此外手术结束后,吉罗·胡特还停止给患者蒂莫西·布朗服用抗艾滋病的药物,因为研究小组担心,这些药物会干扰新骨髓细胞的生长。美国全国免疫疾病和传染病研究所主任安东尼·福奇博士表示,这种手术如果用作临床治疗的话费用太高,而且风险过大,但还是值得鼓励。吉罗·胡特则表示目前不能过于乐观。他说:“藏匿于体内的艾滋病毒有时很狡猾,未被杀清的病毒伙粒就会找机会再冒出来。”[103]同时找到有让CCR5有缺陷的基因又适合移植给某人的骨髓也不容易。[104]
2008年1月,瑞士科学家认为患者接受抗逆转录病毒药物治疗,压制住血液中的病毒后,可能不会通过性途径继续传播病毒[105]。
2012年7月,波士顿布莱根妇女医院的研究员发现,两名患淋巴瘤的HIV带原者,接受压抑HIV的抗逆转录病毒药物治疗期间,移植骨髓后,两人体内血液细胞的HIV基因竟开始消失,逐渐被捐赠者的健康细胞杀死和取代,完全消灭。两人情况与全球首名藉骨髓移植根治HIV的病人蒂莫西·布朗相似,但两人移植的是正常细胞,有别于蒂莫西·布朗的经挑选可抵抗HIV的基因突变细胞。
2022年2月15日,第29届逆转录病毒和机会性感染会议(CROI)上,威尔康奈尔医学院的研究团队表示纽约一名感染艾滋病毒且患有急性髓系白血病的女性在接受了干细胞移植后痊愈,成为全球第一位女性和第三位艾滋病治愈患者[106]。
2018年11月26日南方科技大学副教授(事发时因“外出创业”而处于停薪留职状态)贺建奎在第二届国际人类基因组编辑峰会宣布,一对名为露露和娜娜的基因编辑型试管婴儿于11月在中国诞生。贺建奎称,这一对婴儿因CCR5基因被敲除,具有对艾滋病的免疫力。这对双胞胎基因组中的CCR5基因通过CRISPR-Cas9基因编辑系统敲除,其中一人是杂合敲除(只有一个基因座位上的CCR5基因被敲除)、一人是纯合敲除(一对CCR5基因都被敲除)[107]。此事很快就引发巨大伦理学争议。《自然》杂志将贺建奎列入2018年十大人物,将贺建奎称为“基因编辑流氓”[108]。
2022年,以色列特拉维夫大学通过CRISPR等基因工程技术在小鼠体内对B型白细胞进行改造,以将艾滋病的编码抗体基因带入B细胞,进而使其产生所需的抗体、中和HIV病毒,研究人员预期采取这种创新治疗方法,可通过一次性注射击败病毒,该论文于2022年6月发表在《自然-生物技术》学术期刊上[110][111][112]。领导该项研究的Adi Barzel博士表示,在未来几年内,将能以这种方式生产治疗艾滋病、其他传染病和某些由病毒引起的癌症(如宫颈癌、头颈癌)的药物[113]。
此外,媒体曾多次报道全球的科研人员已发现多种可能有效医治、甚至根治爱滋病的方法,现正进行一连串临床测试,可算是给爱滋病携带者的一线曙光,包括:

6月德国科学家宣布成功从人类细胞中分离出爱滋病毒(HIV),令细胞再次变得健康。爱滋病毒可被一种叫Tre的酶“剪走”,然后恢复健康,2010年前会在老鼠身上进行试验,原本预计2017年前会找出根治爱滋病的方法但最终未成功。[114]
6月加拿大蒙特利尔大学则发现或可彻底治愈爱滋病的方法,使用现时治疗癌症的化学疗法,可将藏在免疫系统记忆T细胞内的爱滋病毒一并杀死,故建议结合化疗及鸡尾酒疗法同时对付爱滋病。[115]
9月美国和泰国研究人员共同宣布,双方合作开发试验的一种“联合疫苗”RV144有希望将人体感染艾滋病病毒的风险降低31.2%。[116]而2020年RV144专案在泰国宣布实验失败,用于高危人群试验者的人体实验后证明没有显著效果能降低感染。
12月
- 加拿大麦吉尔大学研究人员研制开发的新型艾滋病治疗方法首次临床试验获得圆满成功。该疗法可能比目前广泛接受的鸡尾酒疗法更有效。[117]
- 以美国罗切斯特大学教授罗伯特·班巴拉为首的研究小组或发现帮助艾滋病病毒在人体内传播与复制的基因,这项成果将有助于开发治疗艾滋病的疫苗或新药。[118]
- 加州大学洛杉矶分校艾滋病研究所的专家们宣布,他们能够找到一种可以杀死艾滋病病毒的干细胞,将有效的防治艾滋病病毒,该研究成果使成功治疗艾滋病的前景变得更为光明。[119]
- 由捷克和德国的科学家组成的研究小组日前宣布,他们正在研制一种新的化合物,动物实验显示,它能够阻止艾滋病病毒的复制增殖。该化合物日后可能被用于临床药物的开发。[120]
2月
- 英美科学家在1月31日的《自然》上宣布,他们合作进行的新研究发现整合酶的三维结构。整合酶在包括艾滋病病毒等逆转录酶病毒中可以被发现,并且帮助艾滋病毒在人体内复制。这项突破有助于科学家进一步解决艾滋病研究领域长达20年的一个难题,进而找到更佳的治疗艾滋病的方法。[121]
- 美国斯克里普斯研究所2月3日称,该所科学家发现了两种化合物,可作用于人类免疫缺陷病毒(HIV)蛋白酶的新的结合点位,从而为开发出疗效更好、更抗耐药性的新型艾滋病药物奠定了基础。[122]
3月
- 美国研究人员发现,香蕉凝集素能与艾滋病病毒表面的糖类化合物黏连,“封住”病毒遗传物质,从而阻断病毒进入人体的路径。根据这项发现,研究人员或可研究出可以有效治疗艾滋病的新疗法。[123]
- 美国约翰·霍普金斯大学的科学家发现目前正在使用的一种治疗痤疮的抗生素可有效阻止艾滋病毒扩散或复制。[124]
- 法国国家科研中心18日宣布,该机构的研究人员日前合成了一种分子,能够阻止艾滋病病毒在细胞间传播。[125]
12月德国研究员正研发一种针剂名为“VIR-576”的高效爱滋病药物,试验证实能减少患者血液内95%的爱滋病毒。该药原理是先行占据了爱滋病毒用作依靠的蛋白质肽,不让病毒潜藏,从而避免病毒进一步入侵人体免疫细胞。[126]
5月美国研究人员研制爱滋病疫苗取得重大突破,研究人员给24只恒河猴注射实验性疫苗,疫苗含有一种大部份人体内都有的巨细胞病毒(CMV),它的作用是当爱滋病毒最初进入体内,处于最脆弱的时候,立即启动免疫系统攻击病毒。猴子注射疫苗后,有效控制体内爱滋病毒逾一年,而且病毒更逐渐被清除,研究人员希望3年内研制出用于人体测试的爱滋病疫苗。[127]
3月美国圣路易华盛顿大学医学院研究发现,蜜蜂毒液可以杀死爱滋病毒。这项发现为研发预防爱滋涂剂,甚至是爱滋疫苗铺路。[128][129]
9月美国奥勒冈健康与科学大学,研究团队发现,动物实验发现,利用新型疫苗、可以有效杀死“猴免疫缺陷病毒”SIV,而这种病毒比人类免疫缺乏病毒HIV,还要毒十倍,为人类爱滋病治疗带来一线希望。以巨细胞病毒CMV当载具、做成SIV抗原疫苗,并以模拟性行为方式,先给16只猕猴接种疫苗,再让它们感染SIV病毒,然后观察24到30周后,人道毁灭后解剖发现有九只猕猴完全验不出SIV病毒,显示疫苗可以清除SIV病毒。[130]
10月北京大学与清华大学生科联合中心邓宏魁研究组、解放军总医院第五医学中心陈虎研究组、首都医科大学附属北京佑安医院吴昊研究组合作发表期刊论文[131],世界首次以基因编辑干细胞治疗艾滋病的尝试获得突破,该计画由“柏林病人”和“伦敦病人”现象得到启示,认为敲除CCR5受体就能治愈爱滋,问题在于如何敲除,因此CRISPR基因编辑法被纳入一种路径思维,先运用此技术在成体造血干细胞上敲除CCR5基因,结合已经在临床上成熟应用的干细胞移植技术移植给患者,改造过的造血干细胞在患者体内增殖最后也许能起治疗效果,2017年起此专案开始推动,多种尝试研发可能的基因工程技巧,[132]之后为期19个月的临床观察发现CCR5基因编辑的T细胞表现出一定程度抵御HIV感染的能力,且效用长期存在,至此揭开了新一种治愈爱滋病的可能方案,此论文刊登于2019年下旬《新英格兰医学杂志》。
两种理论
少数科学家继续质疑HIV和艾滋病之间的关系,或HIV的存在。诺贝尔奖得主,聚合酶链反应的发明者,被誉为具有“近乎狂人创造者”的凯利·穆利斯,声明HIV并不引起艾滋病[133]。有一些组织,例如包括了上百的“艾滋病不同意见者”的“重新评估HIV和AIDS理论科学团体(Scientific Group for Reappraising the HIV-AIDS hypothesis)”。他们通常拒绝参加艾滋病的会议。持这种意见的科学家从怀疑逆转录酶或艾滋病的存在到流行学结论的测试方法,他们怀疑艾滋病作为一种独立疾病的存在以及批评常规艾滋病研究人员的方法,是为艾滋病重估运动[134]。
现状
到2002年为止,爱滋病这种全球性的传染病没有显示出感染减慢的趋势。据估计,全球有四千万的爱滋病带原者,大约有一千三百万已经死于与爱滋病有关的疾病,主要是肺结核。如果这种趋势继续发展,估计全球爱滋病的死亡数字将达到像黑死病或西班牙流感的死亡数字。
在西方国家,由于对安全性行为的教育,爱滋病病毒的感染率开始有减慢的迹象。但是,在一些特殊人群中,感染率有再次升高的迹象。例如,在英国,诊断为爱滋病的人数从2000年到2001年上升了26%。主要涉及到公众健康工作者,伴随著非法的性工作者和毒品注射者,爱滋病将仍然是一个问题。爱滋病的死亡率也有一定程度的下降,因为有了被证明能有效的压制爱滋病毒的用于治疗爱滋病的药物(目前公认最佳的疗法为“鸡尾酒疗法”)。
在中国大陆地区,第一次发现爱滋病是在1985年6月,从一名阿根廷游客身上发现,最后这位病人在北京协和医院因并发症死亡。截止到1989年底,中国大陆已经发现爱滋病感染者172名,其中大部分是吸毒人士。当年在云南吸毒人群中发现爱滋病标志著中国爱滋病开始流行。中国政府近年来也积极对公众进行爱滋病知识的宣传教育,包括向性工作者和同性恋者间进行安全性行为的教育,但收效甚微,根据国家卫健委官网数据,2021年4月(2021年4月1日0时至4月30日24时),中国大陆地区(不含香港、澳门特别行政区)共报告法定传染病601558例,死亡1549人,其中艾滋病报告5283例,死亡1363例。
在台湾,1984年12月首次发现爱滋病个案,在一名外籍过境旅客验出,并在1986年2月底首次发现台湾人感染案例。1988年起规定捐血者所捐血液要经过检验确定无病毒后才可使用,1990年公布《后天免疫缺乏症候群防治条例》。为增加可能罹患HIV的人筛检的意愿,政府在一些指定医院开办“匿名筛检”。台湾籍的爱滋病感染者及病患在台湾可享受免费的医疗服务,由政府负担相关医疗费用。但2006年1月1日起,爱滋病不再列入台湾全民健康保险重大伤病范围,另由政府编列公务预算;但由于爱滋病患人数上升,对其它疾病及公卫预算产生排挤效应。截至西元2019年11月30日,台湾累计感染人数为39,533人,其中男性占37,444 (94.72% ),而累计全死因死亡人数为6,749人。[135]
在香港,1984年发现的首例受爱滋病病毒感染个案[136];并于1985年发现首宗爱滋病发个案[137]。截至2012年12月31日,香港卫生署的爱滋病病毒感染累积个案统计:自1984年以来,累积发现5,783人[138]受爱滋病病毒感染。自1985年以来,累积发现1,353宗[138]爱滋病个案。在2011年第一季,肺囊虫肺炎是最常见的爱滋病并发症。卫生署提供免费及身份保密的爱滋病抗体检测[139],多年来性行为都是爱滋病感染的主要途径。截至2008年9月统计,自1984年首宗病毒感染个案起,经由性接触感染的爱滋病病毒感染案例占74%;由性接触感染的爱滋病患者占85%。香港的爱滋病活动由政府和多个志愿组织主理。政府主要负责爱滋病感染的监控和政策的制定,并与其他非政府机构一同为社区提供预防或治疗教育和推广工作。
澳门卫生局自1986年首次发现外地输入的爱滋病毒感染个案,截至2012年12月31日,总计有508人[140]感染爱滋病毒,当中73人[140]已病发。45%[140]染病者为从事娱乐行业的外籍人。性接触是主要的传播途径(66%)[140],当中以异性性接触感染最多(56%),同性性接触感染占9%;静脉注射吸毒的感染率占感染个案的14%[140];其馀则为母婴传播、输血感染及不详[140]。
在第三世界国家,经济状况以及缺乏性教育都得感染率维持在很高的比例。一些非洲国家有高达25%的成人劳动力人口是HIV携带者。当中,在非洲中部及东部的十多国[141]的部落传统有为第一次来经、丧夫、流产或堕胎之妇女进行的性清洁习俗,也被认为与爱滋病的传播与成长有关系[142][143][144][145][146][147][148][149][141][150][151],肯尼亚霍马湾郡有逾30%人口是爱滋病病毒携带者,据当地一名日本义工所说,是因为当地人盛行滥交甚至直接走进草丛发生性行为,但少用保险套所致[152],当这些人口表现出爱滋病的病症时,他们将失去工作的能力,同时需要医疗保护。这很可能引起本地区社会和国家的衰退,进一步增加了他们必须面对的困难。这个地区的很多政府多年来一直否认这个问题的存在,直到现在才开始对这种情况进行工作。缺乏医疗保护,对疾病及其起因的无知,以及教育和治疗的资金问题是第三世界爱滋病病人死亡的主要原因。
| 地区 | HIV携带者或 爱滋病患者总数(万) |
新增感染者 | 2020年 死亡人数 |
2020年 正在接受治疗人数(万) | ||
| 合计 | 15岁及以上 | 15岁以下 | ||||
| 非洲东部和南部 | 2 060(1 680-2 440) | 670 000
(470 000-930 000) |
600 000
(410 000-830 000) |
75 000
(49 000-130 000) |
310 000
(220 000-470 000) |
1600
(1540-1610) |
| 亚洲和太平洋地区 | 580(430-700) | 240 000
(170 000-310 000) |
230 000
(170 000-300 000) |
13 000
(8100-18 000) |
130 000
(87 000-200 000) |
370
(350-360) |
| 非洲西部和中部 | 470
(390-580) |
200 000
(130 000-330 000) |
150 000
(87 000-250 000) |
55 000
(35 000-82 000) |
150 000
(100 000-210 000) |
350
(330-350) |
| 拉丁美洲 | 210
(140-270) |
100 000
(66 000-150 000) |
100 000
(65 000-140 000) |
2300
(1400-4200) |
31 000
(20 000-46 000) |
140
(130-140) |
| 加勒比地区 | 33
(28-39) |
13 000
(8700-18 000) |
12 000
(7800-17 000) |
1200
(750-1800) |
6000
(4300-8500) |
22
(21-22) |
| 中东和北非 | 23
(19-31) |
16 000
(12 000-28 000) |
15 000
(11 000-26 000) |
1400
(1100-2100) |
7900
(6000-13 000) |
9.6
(8.9-9.4) |
| 东欧和中亚 | 160
(150-180) |
140 000
(120 000-160 000) |
130 000
(110 000-150 000) |
* | 35 000
(28 000-43 000) |
87
(83-87) |
| 西欧、中欧及北美 | 220
(190-260) |
67 000
(53 000-81 000) |
66 000
(53 000-80 000) |
* | 13 000
(9200-17 000) |
190
(180-190) |
| 合计 | 3770万
(3020万-4510 万) |
150万
(100万-200万) |
130万
(91万–180万) |
150 000
(100 000–240 000) |
680 000
(480 000–1 000 000) |
2 750万
(2 650万-2 770 万) |
*由于数量少,估计数未公布。
世界纪念日
12月1日是世界爱滋病日,这天旨在提高公众对HIV引起的爱滋病在全球传播的意识。订为12月1日是因为第一个爱滋病病例是在1981年此日诊断出来的。从此,爱滋病已造成超过两千五百万人死亡。即使最近世界许多地区的治疗管道已经改善,2005年仍有310万左右(280万到360万之间)人死于爱滋病,其中约有57万人是儿童。
爱滋病日的概念来源于1988年,由全球卫生部长在关于爱滋病预防计划的高峰会议上(World Summit of Ministers of Health on Programmes for AIDS Prevention)提出的。从此,这个概念被全球各国政府、国际组织和慈善机构采纳。
世界爱滋病日的标志是红绸带,表示对HIV阳性者及与他们共同生活者的关怀与接纳,并团结一致对抗爱滋。
图像
-
全球HIV携带者分布(2008年)
-
2012年的国际爱滋医学大会
注释
参考文献
相关条目
外部链接
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads