次氟酸
化合物 来自维基百科,自由的百科全书
次氟酸指化学式为HOF的化合物。有的教科书因此将次氟酸中的氟视作+1氧化态,实际上,该名称并不准确,由于电负性的缘故,“次氟酸”中的氟仍为-1氧化态。它可由水/冰以氟气氧化得到,是唯一可分离出固态的“次卤酸”,具爆炸性,会分解为HF和氧气:[1]
- 2HOF → 2HF + O2
| 氟氧酸 | |
|---|---|
| |

| |
| IUPAC名 Hypofluorous acid | |
| 别名 | 氟氢化氧、氟氧化氢 氟(I)酸 |
| 识别 | |
| CAS号 | 14034-79-8 |
| PubChem | 123334 |
| ChemSpider | 109936 |
| SMILES |
|
| InChI |
|
| InChIKey | AQYSYJUIMQTRMV-UHFFFAOYAN |
| 性质 | |
| 化学式 | HFO |
| 摩尔质量 | 36.0057 g·mol⁻¹ |
| 外观 | 淡黄色液体或白色固体 |
| 熔点 | −117 °C |
| 沸点 | < 0 °C 0°C分解 |
| 相关物质 | |
| 其他阳离子 | LiOF |
| 相关化学品 | HOCl、HOBr |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
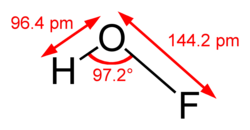
根据X射线晶体学的研究,固态次氟酸分子为角形,键角为101°,[1] O-F和O-H距离分别为1.442和0.78A,分子间有O-H…O键连成的链。右图是气态次氟酸分子的结构。
有机合成
次氟酸是一个较新颖的氧化剂。分子中,O-F键不稳定;氧与电负性比氧强的氟连接,以致当中的氧偏向带正电,因此次氟酸是具有高度亲电性的供氧试剂(次氟酸中的氧有亲电性),应用性极强。[2]
有机合成中最常用的是它的乙腈溶液(HOF·CH3CN)。该溶液具有较高的稳定性,可由氮气稀释的氟气通过含水分的乙腈得到,室温下可稳定存在数小时。一般用它作供氧试剂或羟基化试剂。它参与的反应也称为“Rozen反应”(Rozen oxidation),一般有两个特点:
它参与的反应大致可分为几类:
次氟酸可与烯烃发生环氧化反应,反应通常很快,产率很高,与缺电子的对硝基二苯乙烯反应都能得到70%的产率:[3]
次氟酸与带有双键的羧酸反应时,不需用酯来保护羧基,直接反应即可得到环氧化物,且产率很高。与肉桂酸反应时,虽然分子中双键与羧基相连,但生成环氧化物的产率仍超过90%。[4]
对α-羟基羰基化合物的研究一直吸引着有机化学家的兴趣。用次氟酸作氧化剂氧化烯醇醚(通常为三甲硅基)制得α-羟基羰基化合物的方法,避免了其他方法残留的重金属废料,减少了对环境的污染。一般认为该反应中次氟酸先对烯醇的双键进行环氧化,然后发生氟离子和水分子对环碳原子的亲核进攻,引入羟基,三元环打开。而后氟/羟基及硅基离去,恢复羰基,得到α-羟基羰基化合物。
次氟酸盐
次氟酸盐是含有 OF−(次氟酸的共轭碱)的化合物。
参见
参考资料
外部链接
Wikiwand - on
Seamless Wikipedia browsing. On steroids.





