Loading AI tools
来自维基百科,自由的百科全书
维生素D(英语:Vitamin D)是一种亲脂性类固醇衍生物,为一种激素的前体,属于脂溶性维生素,负责促进肠道对钙、镁和磷酸盐的吸收,另外还有其他多种生物效应[1]。对人类而言,维生素D中最重要的化合物是维生素D2(麦角钙化醇)和维生素D3(又称为胆钙化醇)[2]。维生素D对钙元素在人体内的平衡和代谢中具有重要作用,可用以预防佝偻病和“成人骨软化症”,与钙质合用可以预防出现常见于老年人群的骨质疏松症。此外,维生素D对于神经肌肉功能、炎症都有功效,同时还影响许多基因的表达和翻译,调节细胞的增殖、分化和凋亡[3]。
维生素D的主要天然来源是通过日光照射后在皮肤表皮的下层的化学反应生成胆钙化固醇(特别是UVB辐射)[4][5],而维生素D3需由紫外线照射后,由7-脱氢胆固醇经光照进行光化学反应转变而成,动物皮肤细胞中含有7-脱氢胆固醇,因此多晒太阳是获取维生素D的简易方法。人类一天只需暴露在阳光下10分钟,自身即可合成足够的维生素D3[6]。由于每个人对阳光耐受有差异,而且考虑到罹患皮肤癌的风险,因此关于安全的日照量的建议尚不确定,参考膳食摄入量通常会假设一个人的所有维生素D都是通过口腔摄取[7]。
胆钙化醇和麦角钙化醇可以从饮食和补充剂中摄取[2][8][9]。只有少数食物,例如富含脂肪的鱼类,天然含有显著大量的维生素D[7][10]。在美国和其他国家或地区,牛奶和植物奶的替代品都富含维生素D,而许多早餐谷物也是如此。暴露于紫外线下的蘑菇也能提供有用的维生素D[7]。
饮食中或皮肤合成中的维生素D于生物学上缺乏活性,它需要透过两种蛋白质酶羟基化的步骤激活,首先在肝脏中进行,其后在肾脏中进行。由于大多数哺乳类动物暴露于充足的阳光下即可合成足够分量的维生素D,因此维生素D并非必需的。所以,从技术上讲它并不是一种维生素[9]。相反,它可以被认为是一种激素,其中激活维生素D激素原,形成骨化三醇的活性形式,然后透过核受体在多个位置产生作用[9]。胆钙化固醇在肝脏中转化为骨化二醇(25-羟基胆钙化固醇);麦角钙化醇被转化为25-羟基麦角钙化固醇,然后这些物质作为一种激素重新进入循环系统,调节钙和磷的吸收,促进骨骼的生长和重构。骨化二醇活性不高,必须经肝脏及肾脏的酶促反应,最终生成骨化三醇,这才是其活性最高的形式,可以调节小肠、肾脏和骨骼对钙的吸收与代谢。
维生素D会进一步被肾脏羟化形成维生素D的生物活性形式──骨化三醇(也称为1,25-二羟基胆钙化固醇)[11]。骨化三醇在血液中作为激素循环,主要作用是调节钙和磷酸盐的浓度,并促进骨骼的健康生长和重塑。骨化三醇还具有其他作用,包括对细胞生长、神经肌肉和免疫功能以及减轻炎症的作用[7]。
在血清中测量两种维生素D代谢物(称为25-羟基维生素D或25(OH)D)的含量,可以以此确定一个人的维生素D状况[12][13]。检测血浆中的维生素D3可以反映UVB照射皮肤合成与食物摄入的维生素D的总水平,现在主要认为人体内获取维生素D的主要途径是由人体自身合成。维生素D对人体有益的最佳证据是对骨骼有益处并减少老年女性的死亡率,然而在一般人口统计中并没有一致的证据显示维生素D对健康有影响的效果。
维生素D的发现是由于努力寻找佝偻病儿童(儿童时期的软骨症)所缺乏的饮食物质(维生素D3)[14],此病症较常见于寒带地区,由于当地居民须穿着厚重衣物以防寒,隔绝了阳光对皮肤的照射,因此无法自行生成维生素D3,只能经由饮食摄取来改善。维生素D补充剂可治疗或预防软骨症和佝偻病,然而在普遍人群中对补充维生素D的其他健康影响的证据不一致[15][16]。补充维生素D对死亡率的影响尚不清楚,一项综合分析发现,老年人的死亡率略有下降[17],另一个建议服用补充剂以预防多种疾病的建议则没有明确理由的结论,因此在这些领域中无需进行类似设计的进一步研究[18]。摄取过量的维生素D会导致中毒,因为这会使软组织出现钙化现象。
维生素D有很多种不同的形式存在。两种最主要的维生素D种类分别是维生素D2(麦角钙化醇)和维生素D3(胆钙化醇),它们统称为钙化醇。1932年,研究人员阐明了维生素D2的结构,而人们于1936年发现了维生素D3,并发现它可以由7-脱氢胆固醇经紫外线照射转化而成[19]。没有下标的是涵盖所有维生素D,指D2或D3或是两者,这些统称为钙化醇[20]。维生素D2的化学特征是在1931年获证明,维生素D3的化学结构于1935年建立,并证明是紫外线照射7-脱氢胆固醇而产生的[21]。从化学结构上来说,维生素D都属于开环甾体化合物,也就是甾体激素的一个环状结构打开了[21],维生素D2与维生素D3结构的不同之处在于其侧链,维生素D2的22和23位碳之间是双键,而且在24位碳上多了一个甲基;维生素D3(胆钙化醇)可以由其前体7-脱氢胆固醇经过紫外线照射别构形成,只要让皮肤暴露于充足的紫外光下即可以自然产生足够维生素D3的分量,奶制品厂家通常把牛奶置于紫外线光下,以强化其中的维生素D3。
化学上,各种形式的维生素D都是开环甾体,即类固醇,类固醇环的其中之一个键被破坏[21]。维生素D2和维生素D3之间的结构差异在于D2在碳22和23之间包含着一个侧链,以及在碳24上有一个甲基。
维生素D2是麦角固醇的衍生物,麦角固醇之所以以“麦角”命名,因为它是从一种名为麦角菌的真菌细胞膜上找到的固醇。麦角固醇同时也可以由浮游生物、无脊椎动物以及其他真菌合成。麦角固醇一经合成,在紫外线照射下就可以转化为麦角钙化醇,陆地动物和脊椎动物中的维生素D2,由于它们体内不能合成麦角固醇,但能够合成维生素D3[22],但关于人类只服用维生素D2能否代替维生素D3摄入的讨论,当中的争论还是很激烈[23][24]。
活性维生素D代谢物骨化三醇透过跟主要位于靶细胞的细胞核中的维生素D受体(VDR)结合来介导其生物学作用[21]。骨化三醇与VDR的结合使VDR可以作为转录因子来调节转运蛋白的基因表达(如TRPV6和钙合蛋白),它们参与肠道中钙质的吸收[25]。维生素D受体属于类固醇/甲状腺激素受体的核受体超级家族,以及VDR表现于大多数器官的细胞中,包括脑、心脏、皮肤、生殖腺、前列腺和乳房。
在小肠、骨骼、肾脏及甲状旁腺细胞的VDR激活导致血液中钙和磷的水平得以维持(在甲状旁腺激素和降钙素的辅助下),并维持了骨骼含量[1]。
维生素D的最重要作用之一是透过促进肠道内的钙代谢以维持骨骼中钙质的平衡,并通过增加破骨细胞的数量和保持成骨作用中钙和磷酸盐水平以促进骨吸收,并让甲状旁腺激素的正常运作以维持血清中钙的水平。维生素D缺乏症会导致骨骼矿物质密度降低,并由于缺乏维生素D会改变人体中的矿物质代谢,导致骨密度降低(骨质疏松症)或骨折风险的增加[26]。因此,维生素D通过作为骨吸收中有效刺激物的作用,这对骨骼重塑也至关重要[26]。
VDR调节细胞增殖和细胞分化。维生素D也影响免疫系统,而VDR在几种白细胞中表达,包括单核细胞和激活的T细胞和B细胞[27]。在体外,维生素D增加肾上腺髓质细胞中酪氨酸羟化酶基因的表达,并影响了神经营养因子、一氧化氮合酶及谷胱甘肽的合成[28]。
维生素D受体的表达会随年龄增长而降低,研究结果表明维生素D与肌肉力量、质量和功能直接相关,而所有这些都是影响运动员表现的重要因素[29]。
| 美国 | ||
| 年龄组别 | RDA (IU/日) | (μg/日)[30] |
|---|---|---|
| 0–6个月婴儿 | 400* | 10 |
| 6–12个月婴儿 | 400* | 10 |
| 1–70岁 | 600 | 15 |
| 71+岁以上 | 800 | 20 |
| 怀孕/哺乳 | 600 | 15 |
| 年龄组别 | 容许摄入量上限(IU/日) | (μg/日) |
| 0–6个月婴儿 | 1,000 | 25 |
| 6–12个月婴儿 | 1,500 | 37.5 |
| 1–3岁儿童 | 2,500 | 62.5 |
| 4–8岁儿童 | 3,000 | 75 |
| 9+岁 | 4,000 | 100 |
| 怀孕/哺乳 | 4,000 | 100 [30] |
| 加拿大 | ||
| 年龄组别 | RDA (IU) | 容许摄入量上限(IU)[31] |
| 0–6个月婴儿 | 400* | 1,000 |
| 6–12个月婴儿 | 400* | 1,500 |
| 1–3岁儿童 | 600 | 2,500 |
| 4–8岁儿童 | 600 | 3,000 |
| 9–70岁儿童及成人 | 600 | 4,000 |
| 70岁以上成人 | 800 | 4,000 |
| 怀孕/哺乳 | 600 | 4,000 |
| 澳洲及新西兰 | ||
| 年龄组别 | 充足摄入量(μg) | 最高摄入量(μg)[32] |
| 0–12个月婴儿 | 5* | 25 |
| 1–18岁儿童 | 5* | 80 |
| 19–50岁成人 | 5* | 80 |
| 51–70岁成人 | 10* | 80 |
| 70岁以上成人 | 15* | 80 |
| 欧洲食品安全局 | ||
| 年龄组别 | 充足摄入量(μg)[33] | 可容忍上限(μg)[34] |
| 0–12个月婴儿 | 10 | 25 |
| 1–10岁儿童 | 15 | 50 |
| 11–17岁儿童 | 15 | 100 |
| 成年人 | 15 | 100 |
| 怀孕/哺乳 | 15 | 100 |
| * 充足摄入量,尚未建立RDA/RDI | ||
转换:1μg = 40 IU。
各种机构对维生素D的每日摄入量都提出了不同的建议。这些数据都根据精确的定义,因应不同的年龄、怀孕或哺乳期而有所不同,关于维生素D对皮肤的合成作出了程度的假设[30][31][32][33]。
由美国医学研究所(IoM,2015年更名为美国国家医学研究院)于2010年发布的维生素D膳食参考摄入量,取代了先前的建议,这些建议是根据摄入量表示的。提出建议的前提是,假设由于暴露在阳光下不足,个别人士皮肤不能合成维生素D。维生素D的参考摄入量指的是食物、饮料和补品中的总摄入量,并假设已满足钙的需求[30]。参考膳食摄取量(UL)被定义为“几乎对所有普通人来说的几乎没有健康不利影响风险的每天平均营养素的最高摄入量[30]。”尽管人们认为参考膳食摄取量十分安全,但有关长期影响的信息并不完整,因此不建议长期摄入这些分量[30]。
为了美国食品和膳食补充剂标签的目的,每份的含量表示为每日数值的百分比(%DV)。维生素D标签的目的,每日数值的100%为400 IU(10 μg),然而在2016年5月27日,该标准修订为800 IU(20 μg),以使其与RDA达成一致[35][36]。对于每年食品销售额超过1,000万美元的食品制造商,必须在2020年1月1日之前遵守最新的标签规定,而每年食品销售额不足1,000万美元的食品制造商,则必须于2021年1月1日之前达到更新的标签法规[37][38][39]。在2020年1月1日合规日期之后的前六个月中,FDA计划与制造商合作以达到新的营养成分标签要求,并且在此期间将不着重于针对这些要求的执法行动[37]。参考每日摄入量的新与旧表中列出了每日成人数值量。
根据美国医学研究所的报告[30],加拿大卫生部于2012年发布了建议膳食摄入量(RDA)及维生素D的摄入量上限[31]。
澳洲及新西兰在2005年发布了营养参考值,当中包括了饮食中维生素D的摄入量指南[32]。大约有三分之一的澳洲人缺乏维生素D[40]。
欧洲食品安全局(EFSA)于2016年审视了目前的证据[33],发现血清25(OH)D浓度与与肌肉骨骼健康的结果有很大的差异。他们认为无法得出维生素D的平均需求量与人口参考维生素D的摄入量值,血清25(OH)D浓度为50 nmol / L是合适的目标值。对于所有1岁以上的人们,包括孕妇或哺乳期的妇女,他们设定的每日摄入量为每天15μg(600 IU)[33]。
EFSA审查了2012年的安全摄入量[34],成年人的容许上限为每天100μg(4,000 IU),这与IOM有类似的结论。
英国国民保健署建议6个月至5岁的婴幼儿、怀孕或哺乳妇女,以及缺乏阳光的老年人应每天服用维生素补充剂,以确保摄入足够的维生素D[41]。2016年7月,英国公共卫生部建议每人都考虑在秋季和冬季每天服用10µg的维生素补充剂,因为该时期的日光不足以合成维生素D[42]。
瑞典国家食品管理局建议,对于75岁以下的成人和儿童,每天应摄入10μg(400 IU)的维生素D3,而75岁及以上的成年人应服用20μg(800 IU)的分量[43]。
欧洲的非政府组织提出了其建议:德国营养学会推荐20μg[44];欧洲更年期协会建议更年期妇女于70岁之前服用15μg(600 IU),以及从71岁开始服用20μg(800 IU)。对于某些维生素D含量很低或合并症的患者,该剂量应增加至100μg(4,000 IU)[45]。
因维生素D在大多数食物中都不是天然存在的[2][9],故其通常作为食品强化剂被添加到加工食物中。在某些国家/地区,主食都以维生素D来人工强化[49]。
通常,维生素D2都是发现于真菌中,而维生素D3都在动物中发现[50][51]。维生素D2是由许多真菌中发现的麦角固醇在紫外线照射下产生的。蘑菇和地衣会随着紫外线的照射而增加维生素D2的含量[52][53]。这个过程于工业紫外线灯的模拟下,维生素D2有更高的浓度[51]。
美国农业部报告维生素D2和D3含量合计为一个值:
含有维生素D的加工食品强化包括了一些果汁和果汁饮品,代餐能量棒、大豆蛋白的饮料、某些奶酪和奶酪产品、面粉制品、婴儿配方奶粉、许多早餐谷物和乳制品[55][56]。
2016年,美国食品药品监督管理局(FDA)修改了牛奶强化食品添加剂的法规[57],规定每100克乳制品中的维生素D3含量不得超过42 IU(美国每夸脱的400 IU);每100克的植物奶有84 IU的维生素D2(每夸脱800 IU);而基于植物的乳酪或在大豆饮料产品中,每100克含有89 IU(每夸脱800 IU)[58][59][60]。植物奶被定义为由大豆、杏仁、米以及其他可替代为乳汁的植物来源而制成的饮料[61][62]。
虽然一些研究发现维生素D3可以更快地提高血液中25(OH)D的水平,并在体内保持更长的活跃时间[63][64],然而其他研究则认为维生素D2的来源具有相同的生物利用度,以及如维生素D3般有效用于提高和维持25(OH)D[51][65][66]。
典型的食物中的维生素D含量会因烹饪而减少。煮沸、油炸和烘烤食品可保留原始维生素D的69–89%[67]。

全世界估计有十亿人处于维生素D不足或缺乏[29]。维生素D不足的饮食加上日照不足会导致缺乏维生素D。儿童严重缺乏维生素D会导致患上佝偻病,这是一种骨骼的软化和弱化的疾病,是一种发达国家中罕见的疾病[69]。维生素D缺乏症发现于世界各地的老年人中,在儿童及成年人中仍然很常见[70][71][72]。缺乏症会导致骨骼矿化受损和骨骼损伤,从而导致出现骨骼软化疾病[73],包括儿童的佝偻病和成人的软骨病。避免日晒会导致血液中的骨化二醇(25-羟基维生素D)含量低[74]。维生素D缺乏会导致饮食中肠道对钙的吸收下降至15%[1]。当不缺乏时,一个人通常吸收60-80%[1]。
生活在温带气候中的深色皮肤的人被指出具低维生素D水平,但这个含义并不明确[75][76][77]。深色皮肤的人产生维生素D的效率较低,因为其皮肤里的黑色素会阻碍维生素D的合成[78]。维生素D缺乏症常见于美国的西班牙裔和非裔美国人,其维生素D水平会于冬季中显著下降[22]。这是由于他们皮肤里的黑色素所导致,黑色素是天然的防晒霜[22]。
一种儿童时期的疾病 — 佝偻病,好发于3—18个月大之间[79],其特点是其骨骼生长受到阻碍,变得柔软和虚弱,随着幼童开始学步时,变形的长骨会因其体重的作用下而变得弯曲。北美和其他西方国家相继有病例指出,首见于母乳喂养的初生婴儿,以及肤色较深的人[79]。佝偻症的特征是弓腿[73]——可能是因缺乏钙或磷及缺乏维生素D引起的;如今,该病主要在非洲,亚洲或中东等低收入国家中发现[80]许多患有遗传疾病的人(如伪维生素D缺乏性佝偻病)[81]。
孕妇维生素D缺乏症可能会导致婴儿于出生前就出现明显的骨骼疾病以及出生后骨骼质量受损[82][83]。营养性佝偻病(Nutritional rickets)存在于一年四季都有阳光的国家,例如尼日利亚,并且可在不缺乏维生素D症的情况下发生[84][85]。
尽管现在英国很少发生佝偻病和骨质疏松症,但却大量发生在某些移民社区,其中骨质疏松症的患者包括了穿着西式服装、在看似在充足的日光下进行户外活动的妇女[86]。除非饮食偏离以高摄入量的肉类、鱼类和蛋以及低摄入量的高提取物谷物为特征的西方杂食动物习惯,肤色较黝黑和减少阳光照射不会产生此病[87][88][89]。佝偻病的饮食风险因素包括禁止食用动物食品[86][90]。
在大多数国家中,维生素D缺乏症仍然是婴儿的主要病因,因为母乳中的维生素D含量不足,且社会风气和气候条件使人们避免获得足购的日晒。在阳光充足的国家,例如尼日利亚,南非和孟加拉国,发病于较年长学步的幼会和儿童中,它被归因于饮食中钙摄入量低,这是只能有限地使用乳制品并佐以谷物为基础的饮食[89]。
佝偻病曾是美国的主要公卫问题。在丹佛,同一纬度的紫外线强度比海平面强20%[91],在1920年代后期,近500名儿童中有近三分之二患有轻度的佝偻病[92]。20世纪美国饮食中的动物性蛋白比例增加[90][93]加上牛奶的消耗量增加[94][95],强化相对维生素D含量较少的情况下,佝偻病病例的数字急剧下降[1]。同样,在美国和加拿大,维生素D强化牛奶、婴儿补充剂和维生素补充剂已消除大多数佝偻病儿童所患有的脂肪吸收不良[73]。
骨质疏松症是成年人的维生素D缺乏引起的疾病。该疾病的特征是使骨骼软化,导致脊柱弯曲、腿部弯曲、近端肌肉无力、骨骼脆弱,增加骨折风险[96]。骨质疏松症减少了钙质的吸收并增加了骨骼中钙质的流失,那增加了骨折的风险。骨质疏松症通常出现于25-羟基维生素D水平低于约10ng/mL时[2]。尽管人们认为软骨病的影响可导致慢性肌肉骨骼系统疼痛[97],这里没有具说服力的证据指出慢性疼痛患者出现较低的维生素D水平[98],或该补充剂可减轻慢性非特异性肌肉骨骼疼痛[99]。
维生素D补充剂是预防或治疗佝偻病的一个可靠方法,然而它对非骨骼健康的影响尚未确定[16][100]。2013年的一项评论发现,除了可以降低老年人的死亡率外,并没有发现补充剂对非骨骼疾病发生率有任何影响[101]。维生素D补充剂不会改变心肌梗塞、中风或脑血管疾病、癌症、膝盖骨关节炎的结果[18][102]。维生素D水平可能是疾病引起,而非引致疾病的发生[101]。美国医学研究院(IOM)的一份报告指出:“跟癌症、心血管疾病及高血压,以及糖尿病与代谢综合征相关的结果,跌倒和身体机能、免疫功能和自体免疫性疾病、感染、神经心理机能及子痫前症都不能与钙质或维生素D摄入可靠地联系在一起,并且经常出现相互矛盾[30]。”一些研究人员声称,IOM的建议过于明确,在计算与骨骼健康相关的维生素D水平时犯了数学上的错误[103]。IOM小组成员坚持认为他们使用了“饮食建议的标准程序”,并且该报告是完全基于这些数据。维生素D补充剂的研究,包括了大规模的临床试验,继续正在进行中[103]。
在一般情况下,人们普遍认为维生素D补充剂有助预防骨质疏松症的观点并没有很好的证据支持[18]。它通常用于预防这种疾病,因此那些没有维生素D缺乏症的人可能没有需要[104]。对于患有骨质疏松症的老年人,把维生素D跟钙质一同服用可能有助于预防髋部骨折,但它也会轻微增加了患上胃部及肾脏疾病的风险[105]。在65岁以上的人里,调高剂量的维生素D补充剂可以降低骨折风险[106]。对于独立生活的人而言,其影响是很小甚至是没有的[107][108]。低血清维生素D水平跟跌倒与低骨质密度有关[109]。然而,服用额外的维生素D似乎并没有改变风险[110]。维生素D缺乏症的运动员,特别是那些从事接触运动的人,他们会增加患上疲劳性骨折及/或严重骨折的风险。补充剂最大的好处可见于25(OH)D血清水平不足(<30 ng/mL),或25(OH)D血清水平严重不足(<25 ng/mL)的人身上。血清25(OH)D浓度升高稳定在50 ng/mL时,可观察到风险增加,而在超过这一点的水平上,没有其他可见的额外好处[111]。
由于发现了越来越多的有益于骨骼健康的证据,尽管它没有找到其他益处的充分证据,美国食品药品监督管理局(FDA)自2016年5月起要求制造商于营养标签上声明维生素D的含量,以作为“具有公共卫生意义的营养素”。每年食品销售额少于$1,000万美元的小型制造商透过提议的截止日期延长,将必须在2021年1月1日之前遵守法规,而较大的则必须在2020年1月1日之前遵守[38]。单一成分糖(例如蜜糖和枫糖浆)及某些蔓越莓产品的制造商必须在2021年7月1日之前作出更改[38]。
维生素D补充剂因其声称的抗癌特性而被广泛销售[112]。在观察性研究中,维生素D水平低与某些癌症的发生风险之间存在着关联[113]。然而,尚未清楚在饮食中或作为维生素D补充剂是否会影响癌症的风险。评论把证据描述为“因果关系不一致,不确定,并且不足以告知营养需求”[30],和“不足以得出结论”[107]。2014年的一篇评论发现补充剂对癌症风险没有显著影响[18]。
2014年的另一篇评论得出结论,维生素D3可以降低癌症的死亡风险(在5年内接受治疗的150人中,死亡人数减少了1人),但注意到对数据质量的担忧[17]。尽管有证据表明维生素D缺乏症对某些癌症结果更糟[114],在诊断时有较高的25-羟基维生素D水平与更好的结果有关[115]。
服用维生素D补充剂并不能有效降低中风、脑血管疾病、心肌梗塞或冠状动脉疾病的风险[18][116]。补充剂可能对血压并没有影响[117]。
尽管有初步数据表明哮喘跟维生素D水平低有关,但支持补充剂对哮喘患者具有益作用的证据则没有证据支持[118]。一项评论发现,维生素D补充剂可以减少用于抑制轻度至中度哮喘发作频率类固醇的需要,并且这种补充对日常哮喘症状没有影响[119]。在一般情况下,维生素D补充剂是并不建议用于治疗或预防哮喘[120]。
维生素D含量低与两种人类炎症性肠病(IBD)的主要形式有关:克隆氏症及溃疡性结肠炎[121]。对于患有维生素D缺乏症的IBD患者进行维生素D治疗的综合分析显示,补充剂可有效纠正维生素D水平,并与临床疾病活动及生化标志物指标的改进有关[122]。
通常,维生素D的功能是激活先天免疫系统和抑制后天免疫系统[123]。缺乏症跟病毒性疾病的风险或严重性增加有关,包括HIV[124][125]。维生素D的含量过低似乎是结核病的风险因素[126],在历史上一直被用作治疗用途[127]。补充剂可稍微降低急性呼吸道感染的风险和严重程度,也可减轻哮喘的恶化[128][129]。这里没有证据表明维生素D影响5岁以下儿童的呼吸道感染[130]。
2019冠状病毒病疫情引起人们对维生素D缺乏症可能是呼吸道感染的危险因素的关注[129][131][132][133],但只有初步证据证明维生素D缺乏症和COVID-19感染之间存在直接关联[134]。一项英国的研究发现,当对种群等潜在的混杂因素进行调整时,先前所测量得到的维生素D水平跟COVID-19感染的发生率之间并没有关联[135]。维生素D缺乏症在许多COVID-19病例和死亡人数最多的国家中很普遍,例如美国,西班牙,英国,意大利和伊朗[131][133]。一份由UK NICE发表的证据摘要得出结论,这里没有任何证据支持以维生素D补充剂用作预防或治疗COVID‑19[136]。根据ClinicalTrials.gov,一些第二至四期临床试验正在进行以评估使用维生素D预防或治疗COVID‑19感染的用途。截至2020年5月,大多数研究都处于初步阶段,尚未完成[137]。大多数试验的设计都是用以研究维生素D缺乏症的COVID-19感染者[137][138] 。
政府监管机构针对食物和膳食补充剂行业规定了于包装上声明某些允许范围的健康声明:
初步发现维生素D3补充剂可降低老年人的死亡风险[17][101],但效果尚未得到足够明显和足够肯定使补充剂值得推荐[18]。其他形式(维生素D2、阿法骨化醇和骨化三醇)似乎对死亡风险没有任何有益的作用[17]。血液中较高的水平似乎跟较低的死亡风险有关,但尚未清楚补充剂是否可以带来这种益处[157]。过量及缺乏维生素D都会导致身体功能异常和过早衰老[158][159][160]。血清降钙素水平与死亡率的所有成因之间的关系是呈抛物线的[30]。在黑色人口中出现维生素D含量较低的维生素D危害似乎较低于白色人口[30]。
维生素D毒性很少[72],这是由于高剂量的维生素D补充剂而非阳光引致的。维生素D毒性的下限尚未确定;然而根据一些研究,对于9-71岁的年龄组别的最高容许摄入量(UL)为每天4,000 IU(每天100 µg)[161],而其他研究得出的结论是,在健康的成年人中,持续摄入超过每天1,250μg(50,000 IU)可在几个月后产生明显的毒性,并可以增加血清25-羟基维生素D水平增加至150 ng/mL或更高[72][162]。那些患有某些疾病,例如原发性甲状旁腺功能亢进症[163]对维生素D更加敏感,并为了应对维生素D营养增加时会产生高血钙症,而孕妇在怀孕期间的高钙血症可能会增加对维生素D作用的胎儿敏感性,及智力低下综合征和脸部畸形[163][164]。
突发性婴儿高钙血症(Idiopathic infantile hypercalcemia)是由于CYP24A1的基因突变引致的,导致这种基因突变的婴儿减少对维生素D的降解。患有这种基因突变的婴儿对维生素D的敏感性增加,如果额外摄入的话会有发生高钙血症的风险[165][166]。这种紊乱可以持续到成年[167]。
2015年发表的一篇评论指出,仅在25(OH)D血清浓度高于200 nmol/L时才报告有不良反应[168]。已知的涉及高钙血症的已公布毒性病例(其中已知的维生素D剂量和25-羟基维生素D水平为已知所有每天摄入≥40,000 IU(1,000 μg)[163]。
孕妇或哺乳期妇女在服用维生素D补充剂之前应咨询医生。FDA建议维生素D液体补充剂的制造商应清晰准确地将这些产品随附的滴管标记为400 IU(1 IU为25 ng胆钙化固醇/麦角钙化固醇的生物等效物)。此外,对于用于婴儿的产品,FDA建议滴管的容量不能超过400 IU[169]。对于婴儿(由出生起至12个月),其允许的上限(无伤害的最大可以忍受量)设定为每天25 μg(1,000 IU)。对婴儿来说,每天1,000mg的话,在一个月内会产生毒性[162]。受加拿大和美国政府委托,国家医学科学院(IoM)截至2010年11月30日[update]已将1至3岁年龄段的容许上限(UL)增加至每天2,500 IU,4至8岁的儿童每天3,000 IU,而9-71岁以上则是每天4,000 IU(包括了孕妇或哺乳期妇女)[161]。
骨化三醇本身以负反馈周期自动调节,并且受到甲状旁腺激素、成纤维细胞生长因子23、细胞因子、钙质和磷酸盐的影响[170]。
维生素D过量会引致高钙血症,这是维生素D毒性的强烈显示 — 透过排尿和口渴的增加可以注意到这一点。若高钙血症不获处理,其结果会引致钙质于软组织和器官(如肾脏,肝脏和心脏)有过量的沉积,最后导致疼痛和器官损伤[72][73][96]。
维生素D过量的主要症状都是高钙血症的症状,包括食欲不振、恶心和呕吐。这些可能随后是多尿症、剧渴、虚弱、失眠、紧张、痕痒,最后是肾衰竭。此外,它有可能发展为蛋白尿、管型尿液、氮质血症及转移性钙化(尤其出现于肾脏)[162]。维生素D毒性的其他症状包括幼儿智力低下、骨骼异常生长和形成、腹泻、易怒、体重减轻和严重抑郁[72][96]。
维生素D毒性可透过停止维生素D补充剂并限制钙的摄入来处理。肾脏损害可能是不可逆转的。长时间暴露于阳光下通常不会引起维生素D毒性。在皮肤中产生的维生素D前体的浓度达到化学平衡,并且产生的任何进一步的维生素D都会被降解[163]。
自然界中维生素D的合成取决于紫外线辐射的存在,以及随后在肝脏和肾脏中的激活。许多动物从7-脱氢胆固醇合成维生素D3,许多真菌从麦角固醇合成维生素D2[50][51]。


把7-脱氢胆固醇转化为维生素D3的转化过程涉及两个步骤[171][172]:首先,7-脱氢胆固醇在6-电子顺旋/对旋开环电环化反应中被紫外线以光分解作用光解;其产物为前维生素D3。其次,维生素原D3自发地同分异构至维生素D3(胆钙化醇),在σ迁移反应中的异面与同面。在室温下,维生素原D3在有机溶剂中向维生素D3的转化大约需要12天才能完成。皮肤中维生素原D3向维生素D3的转化比有机溶剂中快约10倍[173]。
麦角固醇向维生素D2的转化遵循相似的过程,透过光解形成维生素原D2,因而会异构化成维生素D2[174]。维生素原D2在甲醇中向维生素D2的转化速率与维生素原D3相约。此过程于白色蘑菇中会更快[51](fig. 3)。

在大多数脊椎动物的皮肤中(包括人类)[175],而裸鼹鼠似乎生来缺乏胆骨化醇[176],因为其血液中检测不到25(OH)D,对某些动物来说,其厚厚的毛皮阻挡了紫外线,而这些鸟兽也有自己的办法,它们把7-脱氢胆固醇分泌到毛皮表面,合成维生素D3后再自己舔回肚子里[177]。
维生素D3是由7-脱氢胆固醇以光化学方式产生的[178]。维生素D3的前体,7-脱氢胆固醇的产量相对较高。7-脱氢胆固醇在290-315 nm的波长下跟UVB光产生反应[179]。这些波长不仅存在于太阳光中,而且存在于室内晒黑中的紫外线灯发出的光(那是主要在UVA的光谱中产生紫外线,但通常会产生UVB总量的4%至10%)。透过窗户暴露的阳光不足,因为玻璃几乎会完全阻挡了UVB的光线[180][181]。
面部、手臂和腿部的皮肤适量地暴露于阳光下,可以产生足够分量的维生素D,而每星期两次,每次平均5–30分钟,又或大约25%的时间,可将晒伤程度降至最低。皮肤颜色越深,日光越微弱,则需要暴露的时间越长。暴露在紫外线下不可能引致维生素D过量:皮肤达到平衡时,该维生素降解的速度与其产生的速度一样快[72][182][183]。
防晒油把紫外线吸收或反射,并防止大部分紫外线到达皮肤[184]。根据UVB光谱得出的防晒系数(SPF)为8的防晒霜可使维生素D的合成能力降低95%,而SPF 15则使其降低98%[30]。
皮肤由两个主要层级组成:主要由结缔组织组成,称为真皮的内层,以及外面比较薄的表皮[185]。厚表皮包括了手掌和脚底的五个层级组成,从外到内,它们是:角质层、透明层、颗粒层、棘层和基底层;维生素D于两个最内层中产生角质形成细胞[186],分别是基底层和棘层[184]。
7-脱氢胆固醇在波长在270-300纳米(峰值295-297纳米)之间的紫外线照射下可以别构转化为维生素D3[187],在阳光中的紫外线指数(夜间的紫外线指数为0,热带、高原地区、晴天时的紫外线指数为15),>3的时候或在日光浴灯下才会有这种能发挥作用的紫外线。日光浴灯产生的紫外线大多数是长波的UVA,而产生维生素D3所需要的是中波紫外线(UVB)占其中的4-10%,从地域上说,热带地区的人每天都可以产生维生素D3,温带地区的人在春夏季节时也可以,而极地地区的人们,该处的紫外线强度几乎不可能使其产生维生素D3[188]。血清25(OH)D的平均浓度的差异似乎应该随纬度升高而降低,然而实际上并不跟预期的一致,例如在夏天,加拿大北部地区的日照强度与时间加起来比赤道地区的还要强,而且高纬度地区的生物于春夏季或秋季都有可能形成并储存足够的维生素D,UVB产生的维生素D功能(无法控制非酶促反应的异构作用)非常强大,以至于皮肤形成多余的维生素D3必须及时降解掉,以免其产生毒性,最终使维生素D的合成和降解达到了平衡的状态[189]。
维生素D透过血流输送到肝脏,在那里转化为激素前体骨化二醇,循环中的骨化二醇在肾脏和单核巨噬细胞系统中转化为骨化三醇,从而成为具有生物活性的维生素D,而在免疫系统中,骨化三醇(1,25(OH)D)发挥着细胞因子的作用,保护机体抵抗微生物入侵[190]。肾脏将骨化二醇转化为骨化三醇释放到血液中,跟维生素的结合蛋白结合,转送到靶器官[21]。骨化三醇透过激活维生素D受体发挥生物学效应,VDR存在于靶细胞表面[21]的激活VDR可以作为转录因子,调节运载蛋白(如TRPV6和钙结合蛋白)的表达,从而参与小肠内钙的吸收[25]。VDR属于核受体中类固醇/甲状腺素受体超级家族,可以在大多数器官中表达,包括脑部、心脏、皮肤、前列腺和乳腺等,VDR在小肠、骨骼、肾脏和甲状旁腺的表达能够保证血钙血磷代谢正常(这与甲状旁腺激素和降钙素协同作用),并可以维持正常骨的质量[191]。维生素D提高了肾上腺髓质细胞酪氨酸羟化酶的表达,也参与了神经营养因子、一氧化氮等物质的合成,并能提高机体谷胱甘肽的水平[28]。现在有意见认为VDR也干预了细胞增殖和分化,而且对免疫系统也起了很强的免疫促进作用,很多种白细胞细胞包括单核细胞、T细胞、B细胞都能够表达VDR[27]。VDR除了可以激活某些基因外,还有其他一些作用机理已经阐明,其中一个非常重要效果是,它可以抑制刺猬激素(一种参与器官形成的激素)的信号转导[192][193]。
维生素D最重要的功能就是保持骨骼中钙质的平衡,它可以增强小肠对钙质的吸收、提高破骨细胞的数量和增强骨吸收、维持血钙及血磷浓度以维持正常骨量,并调整甲状旁腺激素来维持血钙平衡。缺乏维生素D会引致钙磷代谢异常,导致骨质密度降低、骨质流失(骨质疏松症),甚至是骨折。
维生素D只能透过光化学过程合成。海洋中的浮游植物(例如钙板金藻和赫氏圆石藻)已经超过5亿年以来都是一直利用紫外线进行光合作用来合成维生素D。海洋中的原始脊椎动物可以把海洋中的钙质吸收到其骨骼中,并食用富含维生素D的浮游生物来吸收该种维生素。
陆地上的脊椎动物已经超过3.5亿年来以光合作用合成维生素D[194]。 它们的钙化骨骼需要植物以外的另一种维生素D来源。它们必须摄取它,或暴露于阳光下才能在皮肤中进行光合作用[50][173]。对于硬骨类脊椎动物来说,离开富含钙质的海水来到陆地上,维生素D对保证其骨骼中的钙质来说非常重要,由于维生素D的合成必须要有紫外线参与,所以早期登陆岸上的脊椎动物必须把身体暴露于阳光下或者补充富含维生素D的食物来满足其身体对维生素D的需求[173]。
在鸟类和带有皮毛的哺乳类动物中,皮毛或羽毛会阻挡紫外线到达皮肤。相反,维生素D是由沉积于其羽毛或皮毛上皮肤的油性分泌物产生的,在修饰过程中通过口服获得该种维生素[195]。然而,由于无法检测到血清中25-OH维生素D水平,因此某些动物(如裸鼹鼠),是天然胆钙化醇缺乏症的动物[196]。
维生素D3(胆钙化固醇)的生产是通过将7-脱氢胆固醇暴露于UVB光下,然后进行纯化来生产的[197]。7-脱氢胆固醇是鱼类器官特别是肝脏中的天然物质[198],或广泛存在于绵羊的羊毛脂(绵羊油)以及其他动物毛发中的天然物质。
| 皮肤中的7-脱氢胆固醇经紫外线照射后6号电子发生顺旋电环化反应,形成前维生素D3。 | 
|
| 同时前维生素D3透过异侧氢原子σ移位重排,别构产生维生素D3。在室温的条件下,由前维生素D3转化至维生素D3需时12天完成。 | 
|
| 不论是自身合成的还是食物中摄取到的维生素D3,都要在肝脏中处理,在25位碳上加上一个羟基,从而形成25-羟基胆骨化醇(骨化二醇/25(OH)D)[199]。这个过程是由肝脏微粒体酶——25羟化酶催化的,25(OH)D一经合成,便释放到血液中,与α-球蛋白结合,就成为所谓的维生素D结合蛋白α-球蛋白结合体[200]。 | 
|
| 25(OH)D输送到肾脏近段的肾小管,在那里发生1-α(分子下角右边的那个碳原子)位羟化而形成骨化三醇(1,25(OH)2D),可以有效的激活维生素D受体(VDR),激活的VDR介导维生素D所需要发挥的主要功能。25(OH)D向1,25(OH)2D的转换需要25D31-α羟化酶,血液中甲状旁腺激素水平升高可以提高这种酶的合成(当血钙血磷降低时也可以)。 | 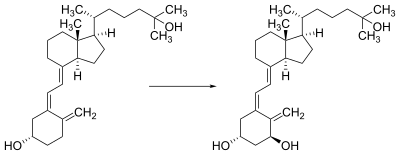
|


维生素D通过血流输送到肝脏,它在这里被转化为前激素降钙素,然后循环中的骨化二醇可在肾脏中转化为骨化三醇,那是肾脏中维生素D的生物活性形式[190]。
无论是在皮肤中合成还是透过摄取而成,维生素D于肝脏中的位置25(分子的右上方)羟基化,以形成25-羟基胆钙化固醇(骨化二醇/25(OH)D)[201]。该反应由CYP2R1这种人类基因微粒体酶的产物催化,并由肝细胞表达[202]。当制成后,该产物会被释放到血浆中,并与称为维生素D结合蛋白的α-球蛋白载体蛋白结合[203]。骨化二醇被输送到肾脏的近端小管,它在1-α位置(分子的右下角)被羟基化,形成骨化三醇(1,25-二羟基胆钙化固醇,1,2,5(OH)2D)。骨化二醇向骨化三醇的转化是通过酶CYP27B1(25-羟基维生素D31-α-羟化酶)催化,这是人类基因“CYP27B1”的产物。CYP27B1活性的增加是透过甲状旁腺激素以及低钙或低磷酸盐的环境[9][190]。
在肾脏的最后转化步骤之后,骨化三醇会释放到循环系统中。通过与维生素D结合蛋白的结合,骨化三醇被输送到整个身体,包括肠道,肾脏和骨骼这些经典目标器官[21]。骨化三醇是维生素D受体中最有效的天然配体,它介导维生素D的大部分生理作用[9][190]。除肾脏外,骨化三醇还由某些其他细胞合成,包括免疫系统中的单核细胞至巨噬细胞。当单核细胞跟巨噬细胞合成时,骨化三醇局部作为细胞因子,通过刺激先天免疫系统调节针对微生物入侵者的身体防御[190]。
骨化二醇和骨化三醇的活性可通过<span class="ilh-all " data-orig-title="维生素D324-羟化酶" data-lang-code="en" data-lang-name="英语" data-foreign-title="Vitamin D3 24-hydroxylase">[[:维生素D324-羟化酶|维生素D324-羟化酶]]的24位,分别形成分别骨钙化醇(secalciferol)和(calcitetrol)进行羟基化来降低[201]。
维生素D2(麦角钙化醇)和维生素D3(胆钙化醇)具有如上所述的相似作用机理[201]。维生素D2产生的代谢物于英文名称上有时以“er-”或“ergo”作为为前缀来命名,使其与基于D3的配对物作区分[204]。
美国研究人员埃尔默·麦柯伦和玛格丽特·戴维斯于1914年在鱼肝油中发现了一种物质,后来称为“维生素A”[14]。英国医生爱德华·梅兰比留意到以鱼肝油喂养的狗没有发展成佝偻病,并得出结论指它是维生素A,或可以预防这种疾病的一个密切相关的因素。1922年,麦柯伦测试了改良的鱼肝油,其中维生素A被破坏了[14]。经改良的鱼肝油治愈了患病的犬只,因此麦柯伦得出结论,鱼肝油中治愈佝偻病的因素不同于维生素A[207][208][209]。他把它称为维生素D,因为它是第四个被命名的维生素[210][211]。最初人们并未意识到,它与其他维生素不同,维生素D可以由人体透过暴露于紫外线下合成。
1925年,当研究人员利用光照射7-脱氢胆固醇时,确立利用光照射7-脱氢胆固醇时,会产生了一种亲脂性维生素(现在称为维生素D3)[14]。阿尔弗雷德·法比安·赫斯指出:“光等于维生素D[212][213]。”德国格丁根大学的阿道夫·温道斯,他于1928年因研究固醇的组成及其与维生素的关系而获得诺贝尔化学奖,以表彰其在研究固醇与维生素之间关系的工作[214]。1929年,位于伦敦汉普斯特德的国立医学研究所(NIMR)的一个小组正在研究目前尚未清楚的维生素D结构,以及类固醇的结构。他们跟约翰·伯顿·桑德森·霍尔丹、J·D·伯纳尔及桃乐丝·霍奇金进行会议讨论了可能的结构,这有助于使小组团结起来。X光晶体学分析显示甾醇分子呈扁平状,这跟温道斯所领导的德国团队提议的有所不同。1932年,奥托·罗森海姆(Otto Rosenheim)和哈罗德·金(Harold King)发表了一篇论文,提出了甾醇和胆汁酸的结构,这个论点立即被接受[215]。团队成员罗伯特·本尼迪·鲍迪永、奥托·罗森海姆、哈罗德·金及肯尼斯·卡洛之间的非正式学术合作非常有成效,并导致维生素D的隔离和表征的发现[216]。当时,英国医学研究委员会的政策不是针对专利发现,而是认为医学研究的结果应该向所有人开放。在1930年代,温道斯进一步阐明了维生素D的化学结构[217]。
1923年,威斯康辛大学麦迪逊分校的美国生物化学家哈利·斯汀博克的研究显示,紫外线照射增加了食物和其他有机物质中维生素D的含量[218][219]。在照射啮齿动物的食物后,斯汀博克发现啮齿动物的佝偻病得到治愈。维生素D缺乏是已知佝偻病的已知病因。斯汀博克于是利用自己的$300美元为其发明申请了专利。他把其技术用于食物,最让人难忘的是用于牛奶。他的专利于1945年到期时,佝偻病在美国几乎被淘汰了[220][221]。
1969年,在研究了肠道细胞的核碎片后,马克·考斯勒(Mark Haussler)与安东尼·W·诺曼鉴定了一种称为维生素D受体的维生素D特异性结合蛋白[222]。在1971–72年,维生素D进一步代谢以活性形式被发现。在肝脏中,维生素D被发现转化为骨化二醇。骨化二醇然后被肾脏转化为骨化三醇 — 维生素D于生物学上的活性形式[11]。骨化三醇作为一种激素在血液中循环,调节血液中钙和磷酸盐的浓度,促进骨骼的健康生长和重塑。维生素D代谢物—骨化二醇和骨化三醇,分别由东尼·诺曼及其同事于赫克托·德卢卡实验室中的跟米高·F·霍利克领导的竞赛团队于实验中确定[223][224][225]。
维生素D缺乏症在欧洲人口中普遍存在着[226]。欧洲正在研究与疾病发生率和饮食建议、食物强化、维生素D补充和日间少量暴露于阳光下的相关政策来评估维生素D的摄入量[56]。除了VDR激活外,各种不同的作用机制正在研究中,例如透过刺猬的生物信号转导,那是一种有关激素的形态发生[192]。
关于维生素D干预益处的证据出现互相矛盾[227],有一种观点认为日晒的每天摄入量为4,000-12,000个IU,同时血清中的25-羟基维生素D水平为40-80ng/mL[228],而另一种观点认为血清浓度高于50ng / mL是不合理的[228][22]。
截至2013年的证据,证据都不足以确定维生素D是否对癌症风险会有影响[229]。美国国家卫生研究院的膳食补充剂办公室于2014年建立了一项维生素D计划,以追踪当时的研究并向消费者提供教育[230]。他们进一步指出:“这些作用的大多数证据来自体外、动物和流行病学研究,而不是被认为更具决定性的随机临床试验。直至此类试验进行之前,将会进行现有关于公共卫生和患者护理问题牵连证据的讨论[7]。”一些初步研究把低水平的维生素D与生命后期的疾病联系在一起[231]。一项综合分析发现老年人的死亡率降低[17]。另一项涵盖超过350,000人的综合分析得出结论,在未经拣选的社区居民中个人补充维生素D不会使骨骼(总骨折)或非骨骼结果(心肌梗塞、缺血性心脏病、中风、结核、脑血管疾病、癌症)减少了15%以上,而且具有类似设计的进一步研究都不太可能改变这些结论[18]。
2019年的综合分析发现,同时服用钙和维生素D可能会增加中风的风险[232]。
维生素D缺乏症已被证明可能会增加患上严重呼吸道感染的风险[129]。在2019冠状病毒病疫情期间,这在2020年引起了人们对该潜力重新产生兴趣。一个对27项出版物的系统评价和综合分析发现,维生素D缺乏症跟更高机会感染COVID-19的可能性并没有关联,但发现到维生素D缺乏症跟疾病的严重程度之间存在着正相关的关系,包括了住院率和死亡率的增加[233]。
2020年6月,美国美国国立卫生研究院发现没有足够的证据建议或反对使用维生素D补充剂作为专门预防或治疗COVID-19[234]。同月,英国国家健康与护理卓越学院发现没有证据支持或反对服用维生素D补充剂为专门预防或治疗COVID-19[235]。这两个组织都提出了一些建议,而这些建议是应继续适用先前出于其他原因而补充维生素D建议(如骨骼和肌肉健康)。两个组织都指出,由于COVID-19大流行期间的日照量较低,可能有更多的人需要补充剂[234][235],而英国国民保健署(NHS)已为COVID-19高危人群免费提供每天维生素D补充剂[236]。
COVID-19的主要并发症是急性呼吸窘迫综合征(ARDS),可能是由于维生素D缺乏症而加剧[237],但这个关联并不明确与冠状病毒感染有关[237]。不同国家将于2020年进行许多试验,以探讨使用维生素D作为预防和治疗SARS-CoV-2感染的潜力[237][137]。
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.