Pyroxen
From Wikipedia, the free encyclopedia
Pyroxen làm nhóm khoáng vật silicat tạo đá quan trọng được tìm thấy trong các đá magma và đá biến chất. Chúng chia sẻ cấu trúc tứ diện silicat mạch và kết tinh theo hệ một nghiêng và hệ trực thoi. Pyroxen có công thức chung là XY(Si,Al)2O6 (trong đó X là Ca, Na, Fe+2 và Mg và ít gặp hơn là Zn, Mn và Li, còn Y là các ion có kích thước nhỏ hơn như Cr, Al, Fe+3, magnesi, mangan, Sc, Ti, V đôi khi có Fe+2). Mặc dù nhôm được thay thế bởi silic trong các khoáng vật silicat như fenspat và amphibol, nhưng sự thay thế này chỉ diễn ra trong phạm vi hạn chế trong hầu hết pyroxen.

Tên pyroxen xuất phát từ tiếng Hy Lạp có nghĩa là lửa và vật lạ. Pyroxen được đặt tên như thế bởi vì nó xuất hiện trong dung nham núi lửa ở dạng tinh thể trong thủy tinh núi lửa; người ta cho rằng chúng là thủy tinh không nguyên chất, nên có tên gọi là "các vật lạ trong lửa". Thật ra, chúng chỉ là các khoáng vật kết tinh trước khi dung nham phun trào.
Phần trên quyển manti của Trái Đất chủ yếu cấu tạo bởi olivin và pyroxen. Mẫu khoáng vật trong hình 1 gồm orthopyroxen màu đen, diopsit (chứa crôm) màu lục sáng, và olivin màu vàng lục, trong đó olivin (dạng peridorit) trội hơn. Pyroxen và fenspat là các khoáng vật chính trong đá bazan và gabbro.
Hóa tính và tên gọi của các loại pyroxen
Cấu trúc silicat mạch của các khoáng vật nhóm pyroxen làm cho chúng rất linh động trong việc liên kết với các cation khác nhau, do vậy tên gọi cũng dựa trên thành phần hóa học của chúng. Các khoáng vật pyroxen được đặt tên dựa trên các nguyên tố tại các vị trí X (hay M2), Y (hay M1), và vị trí T của tứ diện. Các cation tại vị trí Y (M1) được liên kết chặt chẽ với 6 oxy trong các đỉnh của bát diện. Các cation tại vị trí X (M2) có thể kết hợp với 6 hoặc 8 nguyên tử, tùy thuộc vào kích thước cation. Có 20 tên khoáng vật được công nhận bởi Ủy ban về Khoáng vật mới và tên gọi Khoáng vật của Hiệp hội Khoáng vật học Quốc tế và có khoảng 105 tên cũ bị bãi bỏ (Morimoto và ctv., 1989).
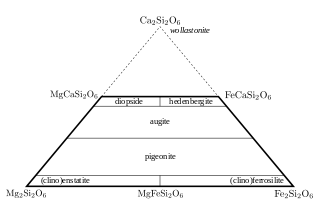
Pyroxen đặc biệt có hầu hết các nguyên tử silic nằm tại đỉnh của tứ diện và các ion +2 chiếm ưu thế hơn ở các vị trí X và Y, theo công thức tương đối XYT2O6. Tên gọi của pyroxen nhóm calci-sắt-magnesi được liệt kê trong hình 2. Chuỗi khoáng vật enstatit-ferrosilit ([Mg,Fe]SiO3) chứa tới 5 mol.% calci và tồn tại ở 3 dạng thù hình là orthoenstatit trực thoi, protoenstatit, và clinoenstatit một nghiêng (cũng tương tự như ferrosilit). Hàm lượng calci tăng chống lại sự tạo thành pha trực thoi (tạo ra orthoenstatit), và pigeonit ([Mg,Fe,Ca][Mg,Fe]Si2O6) chỉ kết tinh theo hệ một nghiêng. Không có dung dịch rắn hoàn hảo chứa calci và pyroxen Mg-Fe-Ca chứa lượng calci khoảng từ 15 đến 25 mol.% thì không bền vững ở dạng tinh thể. Điều này tạo ra một khoảng trống có thể hỗn hợp gữa các thành phần pigeonit và augit. Có sự tách biệt ngẫu nhiên giữa dung dịch rắn augit và diopsid-hedenbergit (CaMgSi2O6 - CaFeSi2O6). Sự phân chia diễn ra khi hàm lượng Ca >45 mol%. Khi ion Ca không thể nhảy vào vị trí Y, thì không tạo ra được pyroxen có hơn 50 mol.% Ca. Khoáng vật tương tự là wollastonit có công thức chỉ toàn Ca nhưng sự khác nhau về cấu trúc làm cho nó không được xếp vào nhóm với pyroxen.

Magnesi, calci và sắt không chỉ chiếm các vị trí X và Y trong cấu trúc của pyroxen, mà còn một nhóm khoáng vật pyroxen quan trọng khác là pyroxen giàu natri, được biểu diễn trên hình 3. Nếu tính natri có điện tích +1 trong pyroxen thì nó thiếu một điện tích dương (+1) vì vậy phải thêm các cation có điện tích +3 vào vị trí Y, ví dụ như jadeit và aegirin có một cation +3 (nhôm hoặc sắt (III)) ở vị trí Y. Pyroxen natri có hơn 20 mol.% calci, magnesi hoặc sắt (II) thường gọi là omphacit và aegirin-augit, còn lớn bằng hoặc hơn 80% thì được gọi tên như trong hình 1.
Bảng 1 thể hiện các cation khác nhau có thể thích hợp nằm trong cấu trúc của pyroxen và vị trí của chúng.
| T | Si | Al | Fe3+ | ||||||||||||||
| Y | Al | Fe3+ | Ti4+ | Cr | V | Ti3+ | Zr | Sc | Zn | Mg | Fe2+ | Mn | |||||
| X | Mg | Fe2+ | Mn | Li | Ca | Na |
Việc lắp các ion vào các vị trí tuân theo nguyên tắc cơ bản là từ trái sang phải và tất cả silic phải nằm ở vị trí T sau đó điền các ion còn lại là nhôm và cuối cùng là sắt (III), nhôm và sắt còn dư có thể lấp vào vị trí Y và ion sắt lớn hơn thì lấp vào vị trí X. Không phải tất cả các kết quả đạt được đều phải cân bằng về điện tích như ví dụ của natri ở trên và có một số cách thay thế tổng quát như sau:
- Ion có hóa trị 1+ và ion 3+ lấp vào vị trí X và Y. Ví dụ như Na và Al trong thành phần của jadeit (NaAlSi2O6).
- Ion có hóa trị 1+ lấp vào vị trí X và 1/2 ion hóa trị 2+ kết hợp với 1/2 ion hóa trị 4+ lấp vào vị trí Y tạo ra NaFe2+0.5Ti4+0.5Si2O6.
- Thay thế một ion 3+ vào vị trí T tương tự với ion ở vị trí Y (2Al1/3) và tạo thành CaAlAlSiO6 (Al thay thế Si ở vị trí T).
Trong tự nhiên, trên cùng một loại khoáng vật thì sự thay thế này rất đa dạng.
Các khoáng vật pyroxen
- Clinopyroxen (Pyroxen đơn tà)
- Aegirin (silicat natri sắt)
- Augit (silicat calci magnesi sắt nhôm)
- Clinoenstatit (silicat magnesi)
- Diopsid (silicat calci magnesi, CaMgSi2O6)
- Esseneit (silicat calci sắt nhôm)
- Hedenbergit (silicat calci sắt)
- Hypersthen (silicat magnesi sắt)
- Jadeit (silicat natri nhôm)
- Jervisit (silicat natri calci sắt scandi magnesi)
- Johannsenit (silicat calci mangan)
- Kanoit (silicat magan magnesi)
- Kosmoclor (silicat natri crôm)
- Namansilit (silicat natri mangan)
- Natalyit (silicat natri vanadi crôm)
- Omphacit (silicat calci natri magnesi sắt nhôm)
- Petedunnit (silicat calci kẽm mangan sắt magnesi)
- Pigeonit (silicat calci magnesi sắt)
- Spodumen (silicat lithi nhôm)
- Orthopyroxen (Pyroxen trực thoi)
- Hypersthen
- Donpeacorit, (MgMn)MgSi2O6
- Enstatit, Mg2Si2O6
- Ferrosilit, Fe2Si2O6
- Nchwaningit (silicat magan hydrat)
- Schefferit, Ca(Mg,Fe,Mn)Si2O6
- Schefferit kẽm, Ca(Mg,Mn,Zn)Si2O6
- Jeffersonit, Ca(Mg,Fe,Mn,Zn)Si2O6
- Leucaugit, Ca(Mg,Fe,Al)(Al,Si)2O6
- Phân tử calci-Tschermak, CaAlAlSiO6
Tham khảo
Liên kết ngoài
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
