بائنڈنگ انرجی
From Wikipedia, the free encyclopedia
کسی ایٹم کے نویہ (nucleus) کو اپنے اجزا میں توڑنے کے لیے جتنی توانائی کی ضرورت ہوتی ہے وہ اس مرکزے کی بائنڈنگ انرجی یا انفصالی توانائی[1] یا ترکیبی اتحادی توانائی[2] کہلاتی ہے۔
کسی مادے کے سب سے چھوٹے ذرے کو جوہر کہتے ہیں جس کے مرکز میں نویہ ہوتا ہے جو نیوٹرون اور پروٹون سے بنا ہوتاہے اور اس کے گرد مختلف مدار میں الیکٹران گردش کرتے ہیں۔ کسی بھی ایٹم کا 99.9 فیصد سے زیادہ وزن اس کے مرکزے کی وجہ سے ہوتا ہے۔
جب ایک نیوٹرون اور پروٹون ایک دوسرے سے جڑتے ہیں تو کچھ توانائ خارج ہوتی ہے۔ جب تک اتنی ہی توانائی دوبارہ نہ ملے یہ نیوٹرون اور پروٹون ایک دوسرے سے جدا نہیں ہوتے۔ توانائی کی یہ مقدار ان کی binding energy ہے۔ مرکزہ اگرچہ نیوٹرون اور پروٹون کے ملنے سے بنا ہوتا ہے لیکن اس کی کمیت ہمیشہ ملنے والے اجزا کی مجموعی کمیت سے کم ہوتی ہے۔ کمیت کی یہ کمی آئن سٹائن کی مساوات E = mc2 کے مطابق توانائی میں تبدیل ہو جاتی ہے۔ مادے میں ہونے والی اس کمی کو mass deficit, mass defect یا mass packing fraction بھی کہتے ہیں۔

ایک پروٹون کی کمیت 1.6726x10−24 گرام ہوتی ہے یعنی 1.00728 amu
ایک نیوٹرون کی کمیت 1.6749x10−24 گرام ہوتی ہے یعنی1.00866 amu (نیوٹرون پروٹون سے 0.14% بڑا ہوتا ہے۔ )
ایک الیکٹرون کی کمیت ایک پروٹون کا 1/1837 حصہ ہوتی ہے یعنی 0.000549 amu
ایک ہیلیم کے ایٹم کے مرکزے میں دو پروٹون اور دو نیوٹرون ہوتے ہیں جن کی کمیت کل ملا کر 4.03188 amu بننی چاہیے مگر پیمائش کرنے پر حاصل ہونے والی کمیت اس سے لگ بھگ 0.75 فیصد کم ہوتی ہے یعنی 4.00153 amu ہوتی ہے۔ اس سے پتہ چلتا ہے کہ دو پروٹون اور دو نیوٹرون جب ملکر ہیلیم کا مرکزہ بناتے ہیں تو 0.03035 amu کے برابر مادہ تحلیل ہو کر توانائ بن جاتا ہے۔ یہ توانائی گاما شعاع کی شکل میں خارج ہوتی ہے جس کی توانائی دوکروڑ 83 لاکھ الیکٹران وولٹ ہوتی ہے۔ یہ توانائی کی بہت بڑی مقدار ہے۔ عام کیمیائی بند (chemical bond) توڑنے کے لیے اس سے کہیں کم توانائی کی ضرورت ہوتی ہے مثلاً ہائیڈروجن کے ایٹم سے الیکٹران نکالنے کے لیے صرف 13.6 الیکٹران وولٹ کی ضرورت پڑتی ہے۔
ایٹم بم اور ہائیڈروجن بم سے نکلنے والی توانائی دراصل یہی بائینڈنگ انرجی ہوتی ہے۔ اس کے برعکس بارود، ٹی این ٹی، نائیٹروگلسرین یا RDX کے پھٹنے سے نکلنے والی توانائی کیمیائی بند (chemical bond) کے ٹوٹنے اور کمتر توانائی کے نئے کیمیائی بند بننے سے خارج ہوتی ہے۔
سورج اور دوسرے ستاروں کی چمک دمک بھی اسی بائینڈنگ انرجی کا نتیجہ ہے۔ ایٹمی بجلی گھر سے حاصل ہونے والی بجلی بھی اسی بائینڈنگ انرجی سے حاصل ہوتی ہے۔
بائینڈنگ انرجی کا گراف
بائینڈنگ انرجی کے گراف سے مراد ایسا گراف ہے جس میں سارے عناصر (elements) کی بائینڈنگ انرجی کو اسی عنصر کے مرکزے میں موجود نیوٹرون اور پروٹون کی کل تعداد (یعنی nucleons کی کل تعداد) سے تقسیم کر کے ظاہر کیا جاتا ہے۔ اس گراف سے پتہ چلتا ہے کہ لوہے اور نکل (nickel) کے ایٹم کے مرکزے سب سے زیادہ پائیدار ہوتے ہیں کیونکہ ان کے بننے کے دوران 8.8 MeV فی نیکلیون توانائی خارج ہو چکی ہوتی ہے اور اب ان مرکزوں کو توڑنے کے لیے پھر اتنی ہی توانائی کی ضرورت ہوتی ہے۔ دوسرے سارے عناصر کے مرکزے اس سے کم تر توانائی پر توڑے جا سکتے ہیں۔
اس گراف سے یہ واضح ہوتا ہے کہ ہلکے عناصر کے مرکزے آپس میں مل کر نسبتاً بھاری عناصر بنا سکتے ہیں اور اس عمل میں توانائی خارج ہوتی ہے مگر یہ سلسلہ لوہے کے مرکزے کے بننے تک ہی جاری رہ سکتا ہے۔ لوہے سے زیادہ بھاری عناصر بنانے میں توانائی خارج نہیں بلکہ جذب ہوتی ہے۔ سورج اور دوسرے ستاروں میں جب درجہ حرارت ایک کروڑ ڈگری سنٹی گریڈ ہوتا ہے تو پروٹون پروٹون چین ری ایکشن کے تحت ہائیڈروجن سے ہیلیم بنتی ہے اور اس طرح کثیر مقدار میں توانائی کا اخراج ہوتا ہے۔ یہ عمل فیوزن (fusion) کہلاتا ہے۔ پھر ایک وقت ایسا آتا ہے جب ساری ہائیڈروجن ختم ہو جاتی ہے۔ اگر ستارہ بڑا ہو اور ٹمپریچر دس کروڑ ڈگری سنٹی گریڈ تک پہنچ جائے تو triple alpha process کے تحت ہیلیئم فیوزن کا عمل شروع ہو جاتا ہے جس سے کاربن بنتا ہے۔ اس گراف سے یہ بھی واضح ہے کہ ہیلیئم سے ہیلیئم کے بعد والا عنصر لیتھیئم نہیں بن سکتا کیونکہ اس عمل میں توانائی جذب ہوتی ہے۔ کاربن کے مرکزوں کو فیوزن کے لیے ایک ارب ڈگری سنٹی گریڈ کی ضرورت ہوتی ہے جو صرف بہت بڑے ستاروں میں ہی ممکن ہے۔ اس کے بعد نیون آکسیجن سلیکون اور لوہا بنتا ہے۔ چونکہ لوہے میں مزید فیوزن نہیں ہو سکتا اس لیے اب بڑے سے بڑا ستارہ بھی اپنے آخری انجام کی طرف چلا جاتا ہے۔
لوہے اور نکل سے بھی زیادہ بھاری عناصر میں فیوزن اور توانائی کا اخراج تو ممکن نہیں مگر fission اور توانائی کا اخراج ممکن ہے۔ ایٹمی بجلی گھر میں یورینیم کی fission سے بجلی حاصل کی جاتی ہے۔
ہلکے عناصر میں لیتھیئم وہ واحد عنصر ہے جس میں یورینیئم اور پلوٹونیئم کی طرح فشن اور توانائی کا اخراج ممکن ہے۔

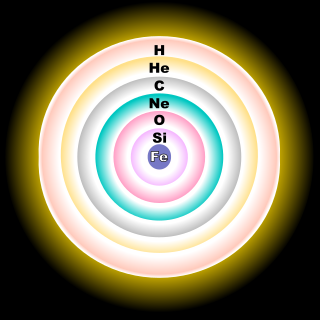

عناصر کی فراوانی
کائنات میں کچھ عنصر بڑی مقدار میں پائے جاتے ہیں اور کچھ بہت کم۔ اس کی وجہ یہی ہے کہ جن عناصر کی بائنڈنگ انرجی کم ہوتی ہے وہ بہت زیادہ پائیدار نہیں ہوتے اور اس لیے کم پائے جاتے ہیں۔ لیکن زیادہ بائینڈنگ انرجی رکھنے والے عناصر بہت پائیدار ہوتے ہیں اور اسی لیے زیادہ مقدار میں پائے جاتے ہیں۔ اگر عناصر کی فراوانی کے گراف پر غور کریں تو پتہ چلتا ہے کہ ہر فراواں کے بعد کم فراواں عنصر ہے۔ اس کی وجہ یہ ہے کہ پروٹون جفت تعداد میں زیادہ پائیداری اور زیادہ بائنڈنگ انرجی رکھتے ہیں بہ نسبت طاق تعداد میں۔

جیسے جیسے ایٹم کا وزن بڑھتا جاتا ہے ان کی فراوانی کم ہوتی چلی جاتی ہے۔ لیتھیئم بریلیئم اور بورون چونکہ کم بائنڈنگ انرجی رکھتے ہیں اس لیے کم پائے جاتے ہیں۔ ہائیڈروجن زیادہ اس لیے ملتی ہے کیونکہ بگ بینگ کے بعد یہی عنصر سب سے زیادہ مقدار میں بنا تھا اور اس وقت بھاری عناصر کا کوئی وجود نہ تھا۔
مزید دیکھیے
- سفید بونا (white dwarf)
- قوی تفاعل (Strong interaction)
- فشن بمقابلہ فیوزن
- ڈبل میجک
- پائیداری عناصر
- یورینیئم
- کریٹیکل ماس
- تابکاری
- spontaneous fission
- Bond energy
- فیوزر
- نیوٹرونی مقطع (neutron cross section)
- ایٹمی ماڈل کا ارتقا
- فوٹوڈس انٹیگریشن
حوالہ جات
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
