Loading AI tools
клінічний синдром невідомого генезу З Вікіпедії, вільної енциклопедії
Синдро́м Каваса́кі або хвороба Кавасакі (англ. Kawasaki syndrome or disease; синоніми — англ. Acute febrile infantile mucocutaneous lymph node syndrome, febrile mucocutaneous lymph node syndrome, mucocutaneous lymph node syndrome) — гостре гарячкове захворювання дитячого віку, ймовірно іммуно-алергічного походження. Характеризується ураженням коронарних та інших судин з можливим утворенням аневризм, тромбозів та розривів судинної стінки. Без адекватного лікування летальність сягає 1 %. Але навіть при інтенсивному лікуванні можлива смерть окремих хворих.
| Синдром Кавасакі | |
|---|---|
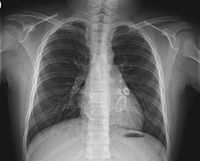 Ураження коронарних судин при синдромі Кавасакі — в тіні серця видно світлі аневризми | |
| Спеціальність | імунологія і педіатр[d] |
| Симптоми | симптом малинового язика, лімфоаденопатія, гарячка, діарея і запалення[1] |
| Препарати | інфліксімаб[2], ацетилсаліцилова кислота і імуноглобуліни для внутрішньовенного введення |
| Класифікація та зовнішні ресурси | |
| МКХ-11 | 4A44.5 |
| МКХ-10 | M30.3 |
| OMIM | 611775 |
| DiseasesDB | 7121 |
| MedlinePlus | 000989 |
| eMedicine | med/1223 ped/1236 |
| MeSH | D009080 |
| | |
Синдром (хворобу) назвали на честь японського лікаря Томісаку Кавасакі[3], який вперше побачив у 1961 році в Токійській клініці Червоного Хреста 4-річного хлопчика з такими проявами, що не мали аналогів у медичній літературі того часу, але описав синдром тільки у 1967 році на підґрунті вивчення симптомів вже у 50 хворих дітей.[4] 2 % їх померли від синдрому. У 1974 році він з співавторами надав ще більш розширений опис синдрому.[5] У 1976 році на Гавайях американський лікар М. Меліш вперше в США описав 12 випадків синдрому серед місцевих дітей.[6]
Синдром Кавасакі на 2018 рік виявляється в усьому світі, хоча найбільше число випадків зареєстровано в Азії. Синдром є основною причиною набутої хвороби серця у дітей в розвинених країнах світу і може бути в подальшому фактором ризику розвитку ішемічної хвороби серця у 25 % дорослих, що перенесли його. У Сполучених Штатах Америки синдром Кавасакі спостерігають у 3000 дітей щорічно, він перевершив за частотою гостру ревматичну гарячку як причину набутих вад серця в дітей у віці до 5 років. На 100 000 дітей, молодших 5 років, припадає 90 % всієї вікової захворюваності, етнічно 32,5 випадків відбуваються в американців азійського походження або вихідців з островів Тихого океану, 16,9 — африканського походження, 11,1 — південноамериканського походження та 9,1 — у білих. У Японії, Тайвані та Кореї захворюваність сягає 6000 випадків за рік, найчастіше протягом січня-червня. В Японії ризик виникнення синдрому в десятки разів вищий ніж у країнах Заходу. Епідемії синдрому відзначені в цій країні 1979, 1982 та 1985 років. Співвідношення уражених хлопчиків до дівчат 1.3-1.83:1[7].
Етіологія невідома. Основною гіпотезою виникнення синдрому вважають дію стафілококових та стрептококових суперантигенів, які стимулюють популяцію Т-лімфоцитів, що призводить до розвитку імунних реакцій, які пошкоджують ендотеліальні клітини. Про це свідчить певна кількість проведених епідеміологічних та імунологічних досліджень. Особливості епідеміологічного поширення синдрому свідчать про виникнення спалахів, перш за все, в кінці зими і навесні з інтервалом 3 роки і хвилеподібного географічного поширення цих спалахів. До інфекційних ознак синдрому належать характерні для інфекційних хвороб гарячка, лімфаденопатія і очні симптоми. Синдром Кавасакі є незвичайним для немовлят у віці до 4-х місяців, припускають, що материнські антитіла можуть забезпечувати їм пасивний імунітет. Епідеміологічні дані свідчать, проте, що від людини до людини передача цього синдрому малоймовірна. Є припущення, що допомагають реалізувати інфекційні фактори в генезі синдрому деякі побутові засоби: килимовий шампунь, зволожувачі повітря, тощо.[8] Є також припущення, що для реалізації синдрому потрібна наявність біля хворого певних мас неводопровідної води (водойми, басейни, тощо). Деякі проведені дослідження показали, що при синдромі Кавасакі відбувається вироблення олігоклональних антитіл, а не поліклональних, як це відбувається у відповідь на суперантигени, що мало б бути, якщо саме ці антигени були етіологічним фактором синдрому.[9] Станом на 2015 рік немає свідчень, що якийсь інфекційний фактор випливає як ведуча причина виникнення синдрому. Виявили, що такими факторами є[10]:
Є припущення, яке ґрунтують на факті виявлення при електронній та оптичній мікроскопії у 85 % хворих, які померли від синдрому Кавасакі, цитоплазматичних тілець, що містять РНК. Такі ж тільця виявили в 25 % дітей з контрольної групи, що не мали синдрому. Висунули гіпотезу, що ці тільця належать невідомому РНК-вмісному вірусу, що є широко поширеним серед дітей і спричинює у більшості малосимптомну чи, взагалі, безсимптомну інфекцію, тоді як у генетично сприйнятливих людей виникає синдром Кавасакі. Автори продовжують пошук цього вірусу.[13]
Також певну роль віддають автоімунним реакціям та генетичним факторам.[14] Виявили, що у братів, сестер постраждалих дітей у 10-20 разів вища ймовірність розвитку синдрому Кавасакі, ніж серед населення в цілому. Японські діти, чиї батьки хворіли свого часу на хворобу Кавасакі, можуть хворіти на тяжчу форму захворювання і бути більш сприйнятливими до рецидиву.[15] Цей ризик 2 членів сім'ї, що мають хвороби Кавасакі є найбільшим для близнюків, для яких цей показник становить близько 13 %.[16] Проведені дослідження показали, що відповідальним за синдром є HLA-Bw22J2, який представляє собою антиген головного комплексу гістосумісності, що відзначали переважно в японських популяціях, тим самим ще більше відзначаючи генетичний вплив на підвищену сприйнятливість до синдрому Кавасакі у японських пацієнтів.[17] Аналіз багатоточкового зв'язку показав докази того, що для виникнення синдрому мають бути проблеми у хромосомі 12 (локус 12q24).[18] Описали також декілька сімей з кількома членами, які страждали на синдром Кавасакі. У цих сім'ях ураження мали місце в 2-х поколіннях або у декількох братів і сестер. Таким чином, генетичні фактори, поліморфні алелі, ймовірно, впливають на сприйнятливість до синдрому.
Є повідомлення, що у деяких хворих синдром розвинувся після вакцинації, зокрема після введення ротавірусної та проти гепатиту В вакцин.

Усі питання патогенезу на сьогодні не є розв'язаними. Вважають, що внаслідок первинних імунних реакцій відбувається запалення судин — васкуліт. Він при синдромі Кавасакі пошкоджує переважно артерії середнього калібру. Розщеплення зовнішньої та внутрішньої еластичних мембран коронарних судин серця призводить до розвитку аневризм. Інтима потовщується, просвіт судини звужується і там можуть утворитися тромби. Незважаючи на те, що запалення найбільш яскраво виражене в коронарних судинах, васкуліт може також виникати у венах, капілярах, дрібних артеріолах та артеріях великого калібру.
На ранніх стадіях захворювання, ендотеліальні клітини і основа судин набряклі, але внутрішня еластична пластинка залишається неушкодженою. Потім, приблизно через 7-9 днів від початку гарячки, відбувається приплив нейтрофілів, який швидко супроводжується поширенням CD8+ цитотоксичних лімфоцитів та імуноглобулін А-продукуючих плазматичних клітин.
Запальні клітини секретують різні цитокіни, інтерлейкіни і матричні металопротеїнази, які націлені на ендотеліальні клітини і призводять до каскаду подій, які проявляються у фрагментації внутрішньої еластичної пластинки і повному пошкодженні судин. У сильно постраждалих судини розвивається запалення з некрозом клітин гладкої мускулатури, пошкодженням усіх 3-х шарів судинної стінки. Внутрішній і зовнішній шари еластичної пластинки можуть відділитися одне від одного, що призводить до аневризми.
Протягом наступних кількох тижнів до кількох місяців, активні запальні клітини замінюються фібробластами і моноцитами, що призводить до формування волокнистої сполучної тканини всередині стінки судини. У дрібних судинах також накопичуються еозинофіли, що є свідченням того, що у запальних реакціях є компонент алергічного, бо еозинофіли знешкоджують гістамін та володіють протизапальними властивостями. Інтима судини проліферується і потовщується. Стінки судин, зрештою, звужуються, може відбутися їхня оклюзія, іноді не тільки через стеноз, але й тромбоз. Серцево-судинна смерть може статися від інфаркту міокарда або від розриву великої аневризми. Збільшення кількості тромбоцитів у периферичній крові відповідає найбільшому ризику смерті від тромбозу при синдромі Кавасакі. В інших органах подальші зміни не відбуваються.
Класифікують синдром Кавасакі у Міжнародному класифікаторі хвороб 10-го перегляду як «Шкірно-слизовий та лімфаденітний синдром (Кавасакі)» (англ. Mucocutaneous lymph node syndrome [Kawasaki]) (М30.3).

Вона починається з раптової появи гарячки і триває в середньому близько 7-14 днів. Гарячка, як правило, є в межах 39-40 °C або вище. Вона не припиняється при призначенні антибіотиків або жарознижувальних засобів і може зберігатися до 3-4 тижнів, якщо хворобу не лікувати адекватно. При відповідній терапії, яка включає високі дози ацетилсаліцилової кислоти і внутрішньовенного імуноглобуліну, гарячка, як правило, зникає протягом 48 годин. На додаток до неї, ознаки та симптоми цієї стадії можуть включати наступні:
Діагноз має бути поставлений у цій стадії.
Ця стадія починається тоді, коли стихає гарячка. Стадія триває до 4-6 тижнів. Відмінними рисами цього етапу є лущення шкіри, тромбоцитоз (кількість тромбоцитів може перевищувати 1 млн / мкл), а також розвиток коронарних аневризм. Ризик раптової смерті є найвищим на цьому етапі. Відзначають на цій стадії також стійку дратівливість, анорексію і продовження кон'юнктивіту. Повернення гарячки за 2-3 тижні може бути ознакою рецидиву. Якщо гарячка зберігається, прогноз для життя є менш сприятливим через великий ризик тяжких серцево-судинних ускладнень.
Більшість випадків рецидивів синдрому відбуваються протягом 2-х років з моменту першого епізоду. Найвищі шанси до рецидиву мають діти до 1 року і ті, хто мав ускладнення з боку серця при першому епізоді.
За відсутності лікування летальність досягає 1 %, у дітей у віці до 1 року може перевищувати 4 %. Пік смертності відбувається через 15-45 днів після початку гарячки. У дорослих не зареєстрували жодного випадку смерті від цього синдрому. У нелікованих хворих аневризми коронарних артерій розвиваються в 25 % випадків. Фактори ризику виникнення аневризм включають:
Лікування в/в імуноглобуліном знижує ризик розвитку аневризм до 10 %. Спонтанну регресію аневризм вінцевих судин спостерігають у половини пацієнтів, однак ризик коронарних подій у них залишається таким самим високим, як у пацієнтів з персистуючими аневризмами. Пізнє встановлення діагнозу та відповідно запізніле лікування є також важливим фактором ризику аневризм.
Показано, що у 50 % тих дітей, в яких аневризма не утворилась, спостерігають зниження функції лівого шлуночка і / або легку клапанну регургітацію на ехокардіографії. Найбільший ризик пошкодження серця є у дітей у віці до 1 року і старших від 5 років, що може бути пов'язано з нетиповим клінічним перебігом в таких випадках, що призводить до затримки у лікуванні.
Зауважте, Вікіпедія не дає медичних порад! Якщо у вас виникли проблеми зі здоров'ям — зверніться до лікаря. |
Для постановки діагнозу синдрому Кавасакі необхідна наявність гарячки більше 5 днів і будь-яких 4 нижчеперелічених критеріїв:
Якщо відсутні 2-3 з 4 обов'язкових ознак хвороби, встановлюється діагноз неповної клінічної картини захворювання.
Такими вважають:
Метою лікування синдрому є зменшення рівня запалення та активації тромбоцитів. Рання та агресивна (настійлива) терапія явно покращує прогноз.
Включає внутрішньовенний імуноглобулін (IVIG) для лікування запалення і для запобігання наслідків ураження коронарних судин. Ацетилсаліцилова кислота традиційно була частиною стандартного лікування. Більшість лікарів використовують високі дози її різною тривалістю, а потім більш низькі дози через її антитромбоцитарні ефекти. Абсорбція ацетилсаліцилової кислоти при прийомі всередину може зменшуватися при синдромі Кавасакі до <50 % (в порівнянні з типовою біодоступністю 85-90 %). Зменшення біодоступності є причиною того, що більш високі дози необхідні для досягнення ефекту. Ібупрофена в лікуванні саме синдрому Кавасакі слід уникати.
Інші антикоагулянти або антиагреганти (наприклад, варфарин, дипіридамол) використовують значно рідше, переважно при виникненні великих аневризм. Глюкокортикостероїди (преднізолон, метилпреднізолон) використовують, як правило, у тих пацієнтів, які не зреагували на стандартні методи лікування. Їх використання на первинному етапі є спірним. Лікування імуноглобуліном разом з метотрексатом або циклофосфамідом було ефективним при тих випадках синдрому, який є резистентним для стандартного лікування. Також в такій ситуації рекомендують інфліксімаб.
За умови виникнення великих аневризм проводять інтервенційну катетеризацію серця, вводять тромболітики. Оскільки існує ймовірність алергічних ускладнень при застосуванні стрептокінази у хворих, у яких був стрептококовий фарингіт протягом останніх 6 місяців і тому, що пусковим фактором синдрому Кавасакі залишається неясним, цього препарату краще уникати. Інші препарати цієї категорії, такі, як тканинний активатор плазміногену, активізатор тенектеплази і урокіназа можуть більше стати в пригоді.
Про плазмоферез говорять як про ефективний метод лікування пацієнтів з синдромом Кавасакі. [джерело?]
Слід довести до відома пацієнта і його сім'ї, що синдром Кавасакі є потенційно смертельним, що він може рецидивувати. Слід наголошувати на необхідності постійного догляду, якщо виникли серцеві ураження. Необхідно вимагати продовження антикоагулянтної терапії, зокрема ацетилсаліциловою кислотою, доти, поки її не припинить лікар. Батьки та інші вихователі повинні розуміти необхідність тісного педіатричного і кардіологічного спостереження, поки хвороба повністю не закінчилась. Лікарі також мають повідомити сім'ю захворілого про потенційний підвищений ризик синдрому Кавасакі серед інших дітей сім'ї. Через необхідність тривалого прийому ацетилсаліцилової кислоти дітьми у гострий період синдрому необхідно провести вакцинацію проти грипу та вітряної віспи.
Випадком, який був начебто пов'язаним з синдромом Кавасакі та отримав найбільш широкого розголосу, став випадок смерті Джетта Траволти, що є рідним сином відомого голлівудського актора та режисера Джона Траволти та Келлі Престон.
Джетт Траволта помер 2 січня 2009 від травми, отриманої внаслідок втрати рівноваги у ванній кімнаті, імовірно, у зв'язку з епілептичним нападом. Лікарі не змогли врятувати життя старшого сина Траволти. Відомо, що у дворічному віці у Джетта діагностували синдром Кавасакі. Хоча начебто прямого зв'язку між смертю і перенесеною в дитинстві хворобою немає, але такий факт мав місце.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.