Loading AI tools
неорганічна сполука З Вікіпедії, вільної енциклопедії
Оксид арсену(III) — неорганічна сполука з хімічною формулою As2O3, що є цінною хімічною сировиною для отримання інших похідних арсену, зокрема арсеновмісних органічних сполук.
| Оксид арсену(III) Білий миш'як | |
|---|---|
 | |
| Ідентифікатори | |
| Номер CAS | 1327-53-3 |
| Номер EINECS | 215-481-4 |
| DrugBank | DB01169 |
| KEGG | D02106 |
| Назва MeSH | D01.075.038 і D01.650.550.125 |
| ChEBI | 30621 |
| RTECS | CG3325000 |
| Код ATC | L01XX27 |
| SMILES | O=[As]O[As]=O[1] |
| InChI | InChI=1S/As2O3/c3-1-5-2-4 |
| Номер Гмеліна | 35185 |
| Властивості | |
| Молекулярна формула | As2O3 |
| Молярна маса | 197.841 |
| Густина | 3.74 |
| Небезпеки | |
| ГДК (Україна) | 0.01 мг/м³ |
| ЛД50 | 14,6 мг/кг (пацюки, орально) |
| Головні небезпеки | надзвичайно токсичний |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Валовий обсяг виробництва в світі — 50 000 т/рік[2] . Однак безпека його застосування в багатьох галузях сумнівна через високу токсичність.
Оксид арсену(III) можна отримати багатьма способами, зокрема окисленням (горінням) арсену і його похідних на повітрі. Показова реакція розкладу аурипігменту, сульфіду арсену :
Більшість, однак, є побічним продуктом інших виробництв — золотодобування й отримання міді, де він виділяється під час прожарення на повітрі, що призводило до численних масових отруєнь[3]. Нині інтенсивний видобуток арсенових руд ведеться тільки в Китаї[2].
Оксид миш'яку(III) є амфотерним оксидом, його розчин має слабокислу реакцію. У лужних розчинах утворює арсеніти, в концентрованій хлоридній кислоті дає хлорид арсену(III).
Тільки деякі окислювачі — озон, пероксид водню, нітратна кислота — здатні перетворити його на оксид арсену(V) As2O5 або — при зниженні концентрації — арсин (AsH3), залежно від умов реакції.
У рідкому й газоподібному (до 800 °C) станах має формулу As4O6 (у формі димеру) і ізоструктурний P4O6. При нагріванні понад 800 °C As4O6 розпадається на молекули As2O3, схожий за будовою з N2O3. У твердому стані співіснують три поліморфних форми: кубічний молекулярний As4O6 і дві полімерні форми. Полімери, що утворюють при охолодженні монокристали, нагадують пірамідальну структуру AsO3 зі спільними атомами кисню.[4]
 |
 |
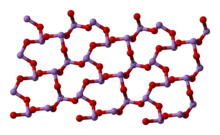 |
(кубічна) |
(моноклінна) |
(моноклінна) |
Оксид арсену(III) використовується для виготовлення кольорового скла, також застосовується в лісохімії й електротехніці напівпровідників[2], отримання чистого арсену та його сполук, таких як какодилат натрію і арсенід натрію.
У сполуці з ацетатом міді(II)[2] триоксид утворює барвник — паризьку зелень, яку нині не використовують через надзвичайну токсичність.
Використовується з найдавніших часів у китайській медицині[5], а також (від XIX століття) в гомеопатії. У конвенційній медицині триоксид арсену використовують для лікування злоякісних пухлин, таких як лейкемія, проте, зважаючи на високі ризики його застосування, перевагу надають іншим препаратам[6][7][8].
Також триоксид арсену успішно лікує автоімунні захворювання[9], взаємодіє з ферментом тіоредоксинова редуктаза[10].
As2O3 міститься в арсеноліті й клаудетиті.

Оксид арсену(III) отруйний. Токсичність триоксиду стала легендарною і широко описана в літературі[11][12][13].
В Австрії жили «миш'якоїди», які одержували дози, що в багато разів перевищують смертельну, без особливої шкоди для здоров'я. Вважається, що миш'як підвищує працездатність, особливо під час роботи на великих висотах[14][15][16].
ГДК для неорганічних сполук арсену, включно з As2O3, становить 0.01 мг/м³.
Напівлетальна доза — 19,1 мг/кг.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.