โซเดียมคลอไรด์ (อังกฤษ: Sodium chloride, สูตรเคมี: NaCl) มีชื่อที่เรียกทั่วไปคือ เกลือแกง เป็นสารประกอบเคมี โซเดียมคลอไรด์เป็นเกลือที่มีบทบาทต่อความเค็มของมหาสมุทร และของเหลวภายนอกเซลล์ของสิ่งมีชีวิตหลายเซลล์ เป็นส่วนประกอบหลักในเกลือที่กินได้ ถูกใช้อย่างกว้างขวางในการเป็นเครื่องปรุงรส และใช้ในการถนอมอาหาร
บทความนี้อาจต้องการตรวจสอบต้นฉบับ เพราะใช้โปรแกรมแปล คุณสามารถช่วยพัฒนาบทความได้ |
 ผลึกโซเดียมคลอไรด์ในรูปของเกลือหิน | |
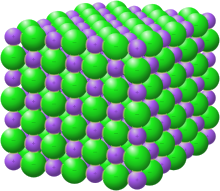 โครงสร้างผลึกที่มีโซเดียมเป็นสีม่วงและคลอไรด์เป็นสีเขียว[1] | |
| ชื่อ | |
|---|---|
| IUPAC name
Sodium chloride | |
ชื่ออื่น
| |
| เลขทะเบียน | |
3D model (JSmol) |
|
Beilstein Reference |
3534976 |
| ChEBI | |
| ChEMBL | |
| เคมสไปเดอร์ | |
| ECHA InfoCard | 100.028.726 |
| EC Number |
|
Gmelin Reference |
13673 |
| KEGG | |
| MeSH | Sodium+chloride |
ผับเคม CID |
|
| RTECS number |
|
| UNII | |
CompTox Dashboard (EPA) |
|
InChI
| |
SMILES
| |
| คุณสมบัติ | |
| NaCl | |
| มวลโมเลกุล | 58.443 g/mol[2] |
| ลักษณะทางกายภาพ | ผลึกลูกบาศก์ไม่มีสี[2] |
| กลิ่น | ไม่มีกลิ่น |
| ความหนาแน่น | 2.17 g/cm3[2] |
| จุดหลอมเหลว | 800.7 องศาเซลเซียส (1,473.3 องศาฟาเรนไฮต์; 1,073.8 เคลวิน)[2] |
| จุดเดือด | 1,465 องศาเซลเซียส (2,669 องศาฟาเรนไฮต์; 1,738 เคลวิน)[2] |
| 360 g/L (25°C)[2] | |
| ความสามารถละลายได้ ใน แอมโมเนีย | 21.5 g/L |
| ความสามารถละลายได้ ใน เมทานอล | 14.9 g/L |
Magnetic susceptibility (χ) |
−30.2·10−6 cm3/mol[3] |
ดัชนีหักเหแสง (nD) |
1.5441 (at 589 nm)[4] |
| โครงสร้าง[5] | |
| Face-centered cubic (see text), cF8 | |
Space group |
Fm3m (No. 225) |
Lattice constant |
a = 564.02 pm |
หน่วยสูตร (Z) |
4 |
Coordination geometry |
octahedral at Na+ octahedral at Cl− |
| อุณหเคมี[6] | |
ความจุความร้อน (C)
|
50.5 J/(K·mol) |
Std molar entropy (S⦵298) |
72.10 J/(K·mol) |
Std enthalpy of formation (ΔfH⦵298) |
−411.120 kJ/mol |
| เภสัชวิทยา | |
| A12CA01 (WHO) B05CB01, B05XA03, S01XA03 | |
| ความอันตราย | |
| NFPA 704 (fire diamond) | |
| ปริมาณหรือความเข้มข้น (LD, LC): | |
LD50 (median dose) |
3 g/kg (oral, rats)[7] |
| สารประกอบอื่นที่เกี่ยวข้องกัน | |
แอนไอออนอื่น ๆ |
โซเดียมฟลูออไรด์ โซเดียมโบรไมด์ โซเดียมไอโอไดด์ โซเดียมแอสทาไทด์ |
แคทไอออนอื่น ๆ |
ลิเทียมคลอไรด์ โพแทสเซียมคลอไรด์ รูบิเดียมคลอไรด์ ซีเซียมคลอไรด์ แฟรนเซียมคลอไรด์ |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
โครงสร้างผลึก
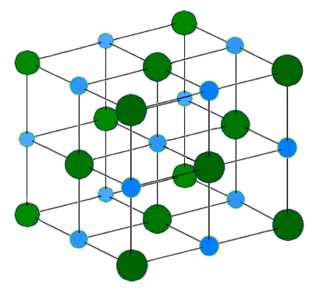
สีน้ำเงินอ่อน = Na+
สีเขียวเข้ม = Cl−
โซเดียมคลอไรด์ จะเกิดผลึกแบบคิวบิก ในโครงสร้างของผลึก ไอออนคลอไรด์ซึ่งมีขนาดใหญ่จะถูกจัดเรียงแบบ ccp ในขณะที่โซเดียมไอออนซึ่งมีขนาดเล็กกว่าจะถูกบรรจุในช่องว่าง ออกตะฮีดรัลระหว่างไอออนคลอไรด์ แต่ละไอออนจะถูกล้อมรอบด้วยไอออนอีกชนิด 6 ตัว ซึ่งเป็นโครงสร้างพื้นฐานเดียวกันกับที่พบในแร่อื่นหลายชนิดและรู้จักกันในชื่อ โครงสร้าง rock-salt
ความสำคัญทางชีววิทยา
โซเดียมคลอไรด์ มีความสำคัญต่อ สิ่งมีชีวิตบนโลกในเนื้อเยื้อชีวภาพ และของเหลวในร่างกาย จะมีเกลือในปริมาณที่แตกต่างกัน ความเข้มข้นของ โซเดียม ไอออนใน เลือด เป็นความสัมพันธ์โดยตรงต่อการควบคุมระดับที่ปลอดภัยของของเหลวในร่างกาย การแพร่กระจายของ การกระตุ้นประสาท โดยซิกนัล ทรานสดักชัน (signal transduction) ถูกควบคุมโดยโซเดียม ไอออน (โพแทสเซียม เป็น โลหะ ที่มีความสัมพนธ์ใกล้ชิดกับโซเดียม ซึ่งเป็นส่วนประกอบหลักในระบบร่างกายเช่นกัน)
0.9% โซเดียมคลอไรด์ ใน น้ำ ถูกเรียกว่า สารละลายทางสรีรวิทยา (physiological solution) หรือ นอร์มัล ซาไลน์ (normal saline) เพราะมันเป็นความเข้มข้นเดียว (isotonic) กับ พลาสมาในเลือด นอร์มัล ซาไลน์ ใช้ในทาง การแพทย์เพื่อทดแทนการสูญเสียของเหลวจากร่างกายและการรักษาแบบนี้ว่า การให้ของเหลวทดแทน (fluid replacement) ซึ่งใช้แพร่หลายทาง การแพทย์ เพื่อป้องกันการ ขาดน้ำ (dehydration) หรือ อินทราวีนัสเทอราปี (intravenous therapy) เพื่อป้องกัน การช๊อค จาก ปริมาตรเลือดต่ำ สาเหตุจากการ สูญเสียเลือด
มนุษย์ไม่เหมือนสัตว์ ไพรเมต ด้วยกันที่สามารถกำจัดเกลือจำนวนมากได้ทาง เหงื่อ (sweating)
การผลิตและการใช้
ปัจจุบันเกลือถูกผลิตโดย การระเหย ของ น้ำทะเล หรือ น้ำเค็ม (brine) จากแหล่งอื่นๆ เช่น บ่อน้ำเค็ม ทะเลสาบน้ำเค็ม (salt lake) และการทำเหมืองเกลือที่เรียกว่า ร็อกซอลต์ (rock salt หรือ เฮไลต์)
ในขณะที่ผู้คนจำนวนมากคุ้นเคยกับการใช้เกลือ ปรุงอาหาร แต่พวกเขาอาจไม่รู้ว่าเกลือใช้ประโยชน์ได้อีกมากมาย เช่น
- ใช้ในการผลิตกระดาษ
- ใช้ในหมึกพิมพ์ผ้าในอุตสาหกรรมเท็กไทล์
- ใช้ในอุตสาหกรรมผลิต สบู่และผงซักฟอก
- ใช้ในการละลายน้ำแข็งที่เกาะบนพื้นถนน ใน แคนาดาและสหรัฐอเมริกา ในช่วงฤดูหนาวที่อุณหภูมิต่ำกว่าจุดเยือกแข็งของน้ำ
- ใช้เป็นวัตถุดิบในการผลิต คลอรีน พีวีซี และยาฆ่าแมลง
| ความสามารถในการละลายของโซเดียมคลอไรด์ในตัวละลายต่างชนิด (g NaCl / 100 g of solvent at 25?C) | |
|---|---|
| H2O | 36 |
| แอมโมเนียเหลว | 3.02 |
| เมทานอล | 1.4 |
| กรดฟอร์มิก | 5.2 |
| ซัลโฟเลน | 0.005 |
| อะซิโตนิไตรล์ | 0.0003 |
| อะซิโตน | 0.000042 |
| ฟอร์มาไมด์ | 9.4 |
| ไดเมทิลฟอร์มาไมด์ | 0.04 |
| Reference: Burgess, J. Metal Ions in Solution (Ellis Horwood, New York, 1978) ISBN 0-85312-027-7 | |
ดูเพิ่ม
อ้างอิง
แหล่งอ้างอิง
แหล่งข้อมูลอื่น
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.

