Loading AI tools
จากวิกิพีเดีย สารานุกรมเสรี
การชำระเลือดผ่านเยื่อ (อังกฤษ: hemodialysis) หรือที่นิยมเรียกว่าการฟอกเลือดหรือการฟอกไต เป็นวิธีการทางการแพทย์ที่กระทำภายนอกร่างกายในการกำจัดของเสียส่วนเกิน เช่น สารในกลุ่มครีเอทีนีนและยูเรียและน้ำออกจากเลือดในผู้ป่วยโรคไตวายซึ่งไตไม่สามารถทำงานได้เป็นปกติ ถือเป็นวิธีการรักษาทดแทนไตชนิดหนึ่ง นอกเหนือจากการปลูกถ่ายไตและการชำระเลือดผ่านเยื่อบุช่องท้อง (peritoneal dialysis) อีกทางเลือกหนึ่งสำหรับแยกส่วนประกอบของเลือดเช่นพลาสมาหรือเซลล์คือ apheresis (กระบวนการหนึ่งที่กระทำภายนอกร่างกายที่เลือดถูกถ่ายออกมาแล้วองค์ประกอบบางอย่างถูกแยกออกโดยการฟอก องค์ประกอบบางส่วนยังคงอยู่ที่เดิม เลือดส่วนที่เหลือจะถูกส่งกลับคืนผู้บริจาคโดยการถ่ายเลือด)


การฟอกเลือดสามารถเป็นการบำบัดสำหรับผู้ป่วยนอกหรือผู้ป่วยใน การฟอกเลือดเป็นประจำจะดำเนินการในศูนย์ฟอกไตผู้ป่วยนอกที่เป็นห้องในโรงพยาบาลที่สร้างโดยเฉพาะหรือห้องที่ทำขึ้นเฉพาะในคลินิกที่อยู่ลำพัง การฟอกเลือดที่ทำที่บ้านมีน้อย การฟอกเลือดในคลินิกจะดำเนินการและบริหารจัดการโดยทีมงานพิเศษจากพยาบาลและช่างเทคนิค; การฟอกเลือดที่บ้านสามารถดำเนินการได้เองและบริหารจัดการร่วมกันด้วยความช่วยเหลือของผู้ช่วยที่ผ่านการฝึกอบรมที่มักจะเป็นสมาชิกในครอบครัว[1]

หลักการของการฟอกเลือดเกี่ยวข้องกับการแพร่กระจายของสารผ่านเนื้อเยื่อที่มีความสามารถซึมผ่านเพียงกึ่งหนึ่ง การฟอกเลือดใช้การทวนกระแสการไหลของเลือด โดยที่สารฟอก (dialysate) ไหลในทิศทางตรงกันข้ามกับการไหลของเลือดในวงจรนอกร่างกาย การไหลทวนกระแสยังคงรักษาความเข้มข้นของส่วนประกอบทางเคมีผ่านเยื่อหุ้มเซลล์ที่จุดสูงสุดและเพิ่มประสิทธิภาพของการฟอกเลือด
การกำจัดของเหลว (การกรองยิ่งยวด (ultrafiltration)) จะกระทำโดยการเปลี่ยนความดันสถิตของน้ำ (hydrostatic pressure) ของช่องเก็บสารฟอก ทำให้เกิดน้ำอิสระและตัวทำละลายเจือจางบางส่วนเพื่อเคลื่อนย้ายข้ามเยื่อกรองไปตามระดับแรงดันตามลำดับ
สารละลายที่ใช้ในการฟอกอาจจะเป็นสารละลายที่ผ่านการฆ่าเชื้อของไอออนของแร่หรือปฏิบัติตามตำรับอังกฤษ (British Pharmacopoeia) ยูเรียและของเสียอื่น ๆ รวมทั้งโพแทสเซียมและฟอสเฟตจะกระจายลงในสารละลายฟอกไต อย่างไรก็ตามความเข้มข้นของโซเดียมและคลอไรด์มีความคล้ายคลึงกับพลาสมาปกติของเลือดเพื่อป้องกันการสูญเสีย โซเดียมไบคาร์บอเนตจะถูกใส่เข้าไปเพื่อเพิ่มความเข้มข้นให้สูงกว่าพลาสมาเพื่อแก้ไขความเป็นกรดในเลือด น้ำตาลกลูโคสจำนวนเล็กน้อยก็ยังถูกนำไปใช้อยู่ทั่วไป
โปรดสังเกตว่ากระบวนการนี้แตกต่างกับเทคนิคการกรองเลือด (hemofiltration)
ใบสั่งแพทย์สำหรับการฟอกเลือดจะออกโดยนักวักกวิทยา (ผู้เชี่ยวชาญทางการแพทย์ด้านไต) ซึ่งจะระบุพารามิเตอร์ต่าง ๆ สำหรับการบำบัดด้วยการฟอกเลือด พารามิเตอร์เหล่านี้รวมถึงความถี่ (จำนวนการรักษาต่อสัปดาห์), ระยะเวลาของการบำบัดในแต่ละครั้งและอัตราการไหลของเลือดและสารละลายฟอกเลือด รวมทั้งขนาดของสารฟอกไต นอกจากนี้ส่วนผสมของสารละลายฟอกเลือดบางครั้งยังมีการปรับเปลี่ยนในแง่ของระดับโซเดียมและโพแทสเซียมและระดับของไบคาร์บอเนต โดยทั่วไป ยิ่งผู้ป่วยมีร่างกายขนาดใหญ่ยิ่งต้องการฟอกเลือดมากขึ้น ในทวีปอเมริกาเหนือและสหราชอาณาจักร การบำบัด 3–4 ชั่วโมง (บางครั้งถึง 5 ชั่วโมงสำหรับผู้ป่วยตัวใหญ่) 3 ครั้งต่อสัปดาห์เป็นเรื่องปกติ การบำบัดสองครั้งต่อสัปดาห์จะถูกจำกัดสำหรับผู้ป่วยที่มีการทำงานของไตที่เหลืออยู่มากพอสมควร สี่ครั้งต่อสัปดาห์มักจะกำหนดให้สำหรับผู้ป่วยที่มีขนาดใหญ่เช่นเดียวกับผู้ป่วยที่มีปัญหาเกี่ยวกับของเหลวที่มากเกินพิกัด ในที่สุดแล้ว มีความสนใจมากขึ้นสำหรับการฟอกเลือดในบ้านระยะสั้นประจำวันซึ่งเป็นการบำบัด 1.5–4 ชั่วโมง 5–7 ครั้งต่อสัปดาห์ นอกจากนี้ยังมีความสนใจในการฟอกเลือดในเวลากลางคืนให้กับผู้ป่วยที่บ้าน 8–10 ชั่วโมงต่อคืน 3–6 คืนต่อสัปดาห์ นอกจากนี้ การฟอกไตในศูนย์ในเวลากลางคืน 3–4 ครั้งต่อสัปดาห์ยังมีให้บริการด้วยเครื่องฟอกไตเต็มกำลังในสหรัฐอเมริกา
การฟอกเลือดมักจะเกี่ยวข้องกับการกำจัดของเหลว (ผ่านการกรองยิ่งยวด (ultrafiltration)) เพราะผู้ป่วยส่วนใหญ่ที่มีภาวะไตวายจะปัสสาวะน้อยหรือไม่มีเลย ผลข้างเคียงที่เกิดจากการเอาของเหลวออกมากเกินไปและ / หรือการเอาของเหลวออกอย่างรวดเร็วเกินไปจะได้แก่ความดันโลหิตต่ำ, ความเมื่อยล้า, การปวดหน้าอก, ตะคริวที่ขา, คลื่นไส้และปวดหัว อาการเหล่านี้สามารถเกิดขึ้นได้ในระหว่างการบำบัดและจะยังคงอยู่หลังจากนั้น; บางครั้งอาการเหล่านี้จะเรียกรวมกันว่าอาการเมาค้างหรือการชะล้างจากการฟอกไต (hangover หรือ dialysis washout) ความรุนแรงของอาการเหล่านี้มักจะเป็นสัดส่วนกับปริมาณและความเร็วของการเอาของเหลวออก อย่างไรก็ตามผลกระทบของจำนวนหรืออัตราการเอาของเหลวออกที่กำหนดจะแตกต่างกันอย่างมากในแต่ละคนและในแต่ละวัน ผลข้างเคียงเหล่านี้สามารถหลีกเลี่ยงได้รวมทั้งอาจลดความรุนแรงของมันลงได้โดยการจำกัดการดื่มของเหลวระหว่างการช่วงการบำบัดในแต่ละครั้งหรือจำกัดการเพิ่มปริมาณยาของการฟอกไต เช่นทำการฟอกให้บ่อยขึ้นหรือใช้เวลานานขึ้นกว่าการบำบัดมาตรฐานที่เกินสามครั้งต่อสัปดาห์ 3–4 ชั่วโมงต่อครั้งตามตารางเวลาการบำบัด
เนื่องจากการฟอกเลือดต้องเข้าถึงระบบการไหลเวียนของเลือด ผู้ป่วยที่เข้ารับการฟอกเลือดอาจเปิดระบบไหลเวียนเลือดของตัวเองให้เผชิญกับจุลินทรีย์ที่สามารถนำไปสู่การติดเชื้อที่มีผลต่อลิ้นหัวใจ (เยื่อบุหัวใจอักเสบ) หรือการติดเชื้อที่มีผลต่อกระดูก (osteomyelitis) ความเสี่ยงของการติดเชื้อแตกต่างกันไปขึ้นอยู่กับชนิดของการเข้าถึงที่ใช้ (ดูด้านล่าง) อาจมีการตกเลือด การติดเชื้ออาจลดลงให้น้อยสุดได้โดยยึดมั่นอย่างเคร่งครัดในการควบคุมการติดเชื้อในทางปฏิบัติให้มากที่สุด
Heparin เป็นสารกันเลือดแข็งที่ใช้กันมากที่สุดในการฟอกเลือด เนื่องจากโดยทั่วไปมันอดทนได้ดีและสามารถกลับตัวได้อย่างรวดเร็วด้วย protamine sulfate การแพ้ Heparin อาจจะเป็นปัญหาไม่บ่อยนักและอาจทำให้เกล็ดเลือดต่ำ ในผู้ป่วยดังกล่าว สารกันเลือดแข็งที่เป็นทางเลือกสามารถนำมาใช้ได้ ในผู้ป่วยที่มีความเสี่ยงการตกเลือดสูง การล้างไตอาจสามารถทำได้โดยไม่ต้องใช้สารกันเลือดแข็ง
First Use Syndrome เป็นปฏิกิริยาการแพ้ (anaphylactic reaction) ที่หายากแต่รุนแรงต่อไตเทียม อาการของมันรวมถึงจาม หอบ หายใจถี่ ปวดหลัง เจ็บหน้าอกหรือเสียชีวิตอย่างกะทันหัน มันอาจเกิดจากสารฆ่าเชื้อ (sterilant) ที่ตกค้างในไตเทียมหรือจากวัสดุของเมมเบรนมันเอง ในปีที่ผ่านมาอุบัติการณ์ของโรค First Use Syndrome ได้ลดลงเนื่องจากการใช้งานที่เพิ่มขึ้นของการฉายรังสีแกมมา การฆ่าเชื้อด้วยการอบไอน้ำ หรือการฉายรังสีลำแสงอิเล็กตรอนแทนการใช้สารฆ่าเชื้อที่เป็นสารเคมี และการพัฒนาของเยื่อ semipermeable ใหม่ที่มีวัสดุชีวะ (biocompatibility) สูง วิธีการใหม่ของขบวนการชิ้นส่วนการฟอกเลือดที่ผ่านการยอมรับก่อนหน้านี้จะต้องนำมาพิจารณาเสมอ ยกตัวอย่างเช่นในปี ค.ศ. 2008 ปฏิกิริยาชนิดแรกของอาการ first-use ได้แก่การเสียชีวิต, ได้เกิดขึ้นจากการปนเปื้อนยา heparin ในระหว่างขั้นตอนการผลิตที่มี chondroitin sulfate ที่มีซัลเฟสมากเกินไป (oversulfated)[2]
ภาวะแทรกซ้อนระยะยาวของการฟอกเลือดจะรวมถึง amyloidosis (การผิดปรกติที่มีลักษณะของการสะสมของ amyloid (สารที่มีลักษณะคล้ายแป้ง) ในอวัยวะหรือในเนื้อเยื่อ) รวมทั้งการอักเสบและรูปแบบต่าง ๆ ของโรคหัวใจ การเพิ่มความถี่และระยะเวลาของการรักษาก็เพื่อปรับปรุงการโอเวอร์โหลดของของเหลวและหลีกเลี่ยงการขยายตัวของหัวใจที่มักเห็นได้บ่อยในผู้ป่วยดังกล่าว[3][4]
ข้างล่างนี้เป็นภาวะแทรกซ้อนเฉพาะที่เกี่ยวข้องกับประเภทของการเข้าถึงที่แตกต่างกันของการฟอกเลือด
ในการฟอกเลือด, มีสามวิธีหลักที่ใช้ในการเข้าถึงเลือด: สายสวนทางหลอดเลือดดำ, การเชื่อมหลอดเลือดแดงและหลอดเลือดดำ (arteriovenous fistula (AV)) และการพ่วงหลอดเลือดแดงและหลอดเลือดดำ ชนิดของการเข้าถึงได้รับอิทธิพลจากปัจจัยต่าง ๆ เช่นช่วงเวลาที่คาดหวังของเส้นทางการไตวายของผู้ป่วยและสภาพของระบบหลอดเลือดของเขา ผู้ป่วยอาจมีการเข้าถึงหลายทาง มักจะเป็นเพราะการเชื่อมหลอดเลือด หรือการพ่วงหลอดเลือดใช้งานได้ดีและสายสวนก็ยังคงนำมาใช้ได้ การเข้าถึงหลอดเลือดสามประเภทหลักเหล่านี้ทั้งหมดทำได้โดยการผ่าตัด[5]
การเข้าถึงด้วยสายสวน หรือบางครั้งเรียกว่า CVC (สายสวนหลอดเลือดดำส่วนกลาง (central venous catheter)) ประกอบด้วยสายสวนทำด้วยพลาสติกหนึ่งเส้นมีสองรู (หรือบางครั้งเป็นสายสวนสองเส้นแยกจากกัน) ซึ่งจะถูกเจาะเข้าไปในหลอดเลือดดำขนาดใหญ่ (ปกติจะเป็นหลอด vena cava ผ่าน internal jugular vein หรือเส้นเลือด femoral vein) เพื่อให้กระแสของเลือดขนาดใหญ่ถูกดึงออกจากรูหนึ่ง ป้อนเข้าวงจรการฟอกเลือดแล้วส่งเลือดกลับผ่านทางอีกรูหนึ่ง อย่างไรก็ตามการไหลของเลือดมักจะน้อยกว่าการเข้าถึงแบบเชื่อมหรือแบบพ่วงที่สามารถทำงานได้ดีเสมอ
หลอดสวนมักจะพบในสองแบบทั่วไปคือแบบท่อลอดและแบบไม่ใช่ท่อลอด
้การเข้าถึงด้วยสายสวนแบบไม่ใช่ท่อลอดจะใช้สำหรับการเข้าถึงระยะสั้น (ไม่เกิน 10 วัน แต่มักจะใช้ฟอกไตเพียงครั้งเดียวเท่านั้น) โดยสายสวนจะโผล่ออกมาจากผิวหนังที่ตำแหน่งเดียวกับที่เจาะเข้าไปในหลอดเลือดดำ
การเข้าถึงด้วยสายสวนแบบท่อลอดเกี่ยวข้องกับสายสวนที่ยาวกว่า ซึ่งมันจะถูกปักเข้าไปใต้ผิวหนังจากจุดที่เจาะเข้าในหลอดเลือดดำลอดไปออกอีกจุดหนึ่งที่ห่างออกไป มันมักจะถูกสอดไว้ใน internal jugular vein ในลำคอและจุดออกมักจะอยู่บนผนังหน้าอก ท่อลอดจะใช้เป็นอุปกรณ์ขวางกั้นการบุกรุกของจุลินทรีย์ ดังนั้นสายสวนแบบท่อลอดจึงถูกออกแบบมาสำหรับการเข้าถึงระยะสั้นถึงระยะกลาง (เป็นสัปดาห์ถึงหลายเดือนเท่านั้น) เพราะการติดเชื้อยังคงเป็นปัญหาที่พบบ่อย
นอกเหนือจากการติดเชื้อ หลอดเลือดดำตีบก็เป็นอีกปัญหาหนึ่งที่ร้ายแรงเมื่อใช้การเข้าถึงแบบสายสวน สายสวนเป็นสิ่งแปลกปลอมในหลอดเลือดดำและมักจะกระตุ้นให้เกิดการอักเสบที่ผนังหลอดเลือดดำ ซึ่งส่งผลให้เกิดแผลเป็นและการตีบของหลอดเลือดดำที่มักจะเป็นจุดที่มีการเสียดสี อาจทำให้เกิดปัญหากับความแออัดของหลอดเลือดดำที่รุนแรงในบริเวณที่ระบายออกโดยเส้นเลือดดำและยังอาจทำลายหลอดเลือดดำและหลอดเลือดดำรั่ว มันจะไร้ประโยชน์สำหรับการเข้าถึงแบบเชื่อมหรือแบบพ่วงในภายหลัง ผู้ป่วยที่ทำการฟอกเลือดในระยะยาวจะไม่เหลือจุดการเข้าถึงอย่างสิ้นเชิง ดังนั้นนี่อาจจะเป็นปัญหาร้ายแรง
การเข้าถึงด้วยสายสวนมักจะใช้สำหรับการเข้าถึงอย่างรวดเร็วสำหรับการฟอกเลือดในทันที สำหรับการเข้าถึงแบบท่อลอดในผู้ป่วยที่มีแนวโน้มว่าจะฟื้นตัวจากภาวะไตวายเฉียบพลันและสำหรับผู้ป่วยไตวายระยะสุดท้ายที่กำลังรอคอยการเข้าถึงทางเลือกอื่นที่จะสมบูรณ์หรือผู้ที่ไม่สามารถเข้าถึงได้ด้วยทางเลือกอื่น
การเข้าถึงด้วยสายสวนมักจะเป็นที่นิยมกับผู้ป่วยเพราะสิ่งที่แนบมากับเครื่องฟอกไตไม่ต้องใช้เข็ม อย่างไรก็ตามความเสี่ยงที่ร้ายแรงของการเข้าถึงด้วยสายสวนที่ระบุไว้ข้างต้นหมายความว่าการเข้าถึงดังกล่าวควรจะมีการไตร่ตรองว่าเป็นเพียงการแก้ปัญหาระยะยาวในสถานการณ์การเข้าถึงที่สิ้นหวังมากที่สุด
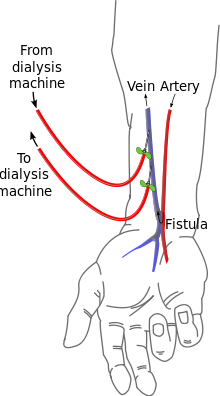

การเชื่อมหลอดเลือดแดงและหลอดเลือดดำ (AV (arteriovenous) fistulas) เป็นวิธีการเข้าถึงหลอดเลือดที่นิยมกัน ศัลยแพทย์หลอดเลือดจะเชื่อมหลอดเลือดแดงและหลอดเลือดดำเข้าด้วยกันโดยการเชื่อมประสาน (anastomosis) เนื่องจากเป็นการบายพาสเส้นเลือดฝอย เลือดจะไหลอย่างรวดเร็วผ่านจุดเชื่อมนี้ ผู้ป่วยสามารถรู้สึกได้โดยวางนิ้วของเขาบนรอยต่อนี้ เขายังสามารถฟังผ่านหูฟังซึ่งจะได้ยินเสียงของเลือดที่ไหลผ่านจุดเชื่อมนี้
จุดเชื่อมมักถูกสร้างขึ้นในแขนที่ไม่ถนัดและอาจจะอยู่ในมือ (เรียกว่า 'snuffbox') ที่แขน (เรียกว่า 'radiocephalic' หรือเรียกว่า Brescia-Cimino โดยที่หลอดเลือดแดง radial ถูกประสานกับหลอดเลือดดำศีรษะ (cephalic vein)) หรือที่ข้อศอก (ที่เรียกว่า brachiocephalic fistula ที่หลอดเลือดแดงที่แขน (brachial artery) จะถูกประสานกับหลอดเลือดดำศีรษะ (cephalic vein)) แม้ว่าจะพบได้น้อยกว่า จุดเชื่อมยังสามารถถูกสร้างขึ้นในขาหนีบ แต่ขั้นตอนการประสานอาจแตกต่างกัน ตำแหน่งในขาหนีบมักจะถูกเลือกเมื่อตำแหน่งที่แขนและมือไม่สามารถใช้ได้เนื่องจากลักษณะทางกายวิภาคหรือเนื่องจากล้มเหลวของจุดเชื่อมก่อนหน้านี้ที่ทำบนแขน / มือ จุดเชื่อมจะใช้เวลาหลายสัปดาห์ที่จะสมบูรณ์ใช้งานได้ โดยเฉลี่ยอาจจะใช้เวลา 4–6 สัปดาห์
ในระหว่างการบำบัด เข็มทั้งสองจะถูกปักลงไปในช่องจุดเชื่อม เข็มหนึ่งจะใช้ในการดึงเลือดออกมาและอีกเข็มหนึ่งจะใช้ส่งเลือดกลับไป การวางตัวของเข็มจะพืจารณาถึงการไหลปกติของเลือด้ เข็ม"เลือดแดง" จะดึงเลือดออกจากตำแหน่ง "ต้นน้ำ" ในขณะที่เข็ม "เลือดดำ"จะส่งเลือดกลับ "ท้ายน้ำ" การปักเข็มสลับกันจะนำไปสู่การรีไซเคิลบางส่วนของเลือดเดียวกันผ่านเครื่องฟอกไตทำให้การบำบัดมีประสิทธิภาพน้อยลง
ข้อดีของการเชื่อมหลอดเลือดก็คือมีอัตราการติดเชื้อต่ำ เพราะไม่มีสิ่งแปลกปลอมมาเกี่ยวข้อง อัตราการไหลเวียนของเลือดจะสูงขึ้น (ซึ่งแปลว่าการฟอกไตมีประสิทธิภาพมากขึ้น) และอัตราการเกิดลิ่มเลือดลดลง ภาวะแทรกซ้อนจะน้อยกว่าเมื่อเทียบกับวิธีการเข้าถึงแบบอื่น ๆ ถ้าจุดเชื่อมมีการไหลเวียนเลือดที่สูงมากและเส้นเลือดที่ให้เลือดส่วนที่เหลือของแขนขาทำงานไม่ดี อาจเกิดอาการที่เรียกว่า steal syndrome ขึ้นได้ นั่นคือเลือดที่ไหลเข้าแขนขาจะถูกดึงเข้าสู่จุดเชื่อมและถูกนำกลับคืนไปสู่ระบบหมุนเวียนทั่วไปโดยไม่ได้ป้อนเข้าสู่เส้นเลือดฝอยของแขนขา อาการนี้ส่งผลในแขนขาเย็น เป็นตะคริว และถ้ารุนแรงเนื้อเยื่ออาจเสียหาย ภาวะแทรกซ้อนในระยะยาวอันหนึ่งของการเชื่อม AV ก็คือการพัฒนาไปสู่ภาวะเส้นโลหิตแดงโป่งพองเป็นถุงขังโลหิต (aneurysm), การปูดในผนังของหลอดเลือดดำที่จะอ่อนแอลงเนื่องจากโดยการแทงซ้ำ ๆ กันของเข็มเมื่อเวลาผ่านไป แต่ความเสี่ยงของการพัฒนาไปสู่ภาวะเส้นโลหิตแดงโป่งพองเป็นถุงขังโลหิตจะลดลงโดยการหมุนตำแหน่งเข็มอย่างระมัดระวังไปทั่ว ๆ จุดเชื่อม หรือใช้เทคนิค "รังดุม" (ตำแหน่งคงที่) ภาวะเส้นโลหิตแดงโป่งพองเป็นถุงขังโลหิตอาจจำเป็นต้องมีการผ่าตัดเพื่อแก้ไขและอาจร่นอายุการใช้งานของจุดเชื่อม จุดเชื่อมยังสามารถอุดตันได้เนื่องจากการแข็งตัวของเลือดหรืออาจติดเชื้อได้ถ้าไม่ได้ปฏิบัติตามข้อระมัดระวังในการฆ่าเชื้อระหว่างการแทงเข็มในช่วงเริ่มต้นของการฟอกเลือด เนื่องจากปริมาณสูงของเลือดที่ไหลผ่านจุดเชื่อม การตกเลือดอย่างหนักอาจเกิดขึ้นได้ นี่พบมากที่สุดหลังจากการฟอกไต ต้องใส่ความดันที่หลุมเข็มเพื่อให้เกิดการแข็งตัว ถ้าความดันถูกเอาออกก่อนเวลาอันควรหรือผู้ป่วยที่เข้าร่วมในกิจกรรมทางกายภาพเร็วเกินไปหลังจากการล้างไต หลุมเข็มสามารถเปิดออกได้
เพื่อป้องกันไม่ให้เกิดความเสียหายต่อจุดเชื่อมและภาวะเส้นโลหิตแดงโป่งพองเป็นถุงขังโลหิตหรือการก่อตัวของภาวะเส้นโลหิตแดงโป่งพองเป็นถุงขังโลหิตปลอม (pseudoaneurysm formation) มีข้อแนะนำว่าเข็มจะถูกแทงที่จุดแตกต่างกันในแบบหมุนเวียน อีกวิธีหนึ่งคือการฝังท่อพลาสติคเล็ก ๆ ด้วยเข็มทื่อ, ในตำแหน่งเดียวกัน วิธีการนี้เรียกว่า 'รังดุม' บ่อยครั้งที่มีรังดุมสองหรือสามที่ในจุดเชื่อมเดียว นอกจากนั้น วิธีการนี้ยังสามารถยืดอายุจุดเชื่อมและช่วยป้องกันไม่ให้เกิดความเสียหายต่อจุดเชื่อมอีกด้วย

การพ่วงหลอดเลือดดำและหลอดเลือดแดงเป็นเหมือนการเชื่อมในหลาย ๆ ส่วน ยกเว้นแต่ว่าจะใช้หลอดเลือดเทียมในการต่อหลอดเลือดแดงเข้ากับหลอดเลือดดำ หลอดเลือดเทียมมักจะทำจากวัสดุสังเคราะห์เช่น Polytetrafluoroethylene (PTFE) แต่บางครั้งก็ใช้หลอดเลือดดำจากสัตว์ที่ผ่านการบำบัดทางเคมีและฆ่าเชื้อโรคแล้ว หลอดเลือดเทียมจะถูกใส่เข้าไปเมื่อเส้นเลือดธรรมชาติของผู้ป่วยไม่สามารถให้ทำการเชื่อมแบบ fistula ได้ หลอดเลือดเทียมสามารถพร้อมใช้งานได้เร็วกว่า fistulas และอาจจะพร้อมใช้งานเป็นเวลาไม่กี่สัปดาห์หลังจากการผ่าตัด (บางกรณีใหม่ ๆ อาจจะใช้งานได้เร็วกว่านี้) อย่างไรก็ตามการพ่วง AV มีความเสี่ยงสูงในการพัฒนาไปสู่หลอดเลือดตีบ โดยเฉพาะอย่างยิ่งในจุดที่ถัดจากแผลเย็บจากการโยงหลอดเลือดดำ การตีบมักจะนำไปสู่การเกิดลิ่มเลือด (เลือดแข็งตัว). เนื่องจากเป็นสิ่งแปลกปลอม หลอดเลือดเทียมมีความเสี่ยงมากขึ้นสำหรับการติดเชื้อ มีตัวเลือกเพิ่มเติมสำหรับตำแหน่งที่จะวางหลอดเลือดเทียมเพราะสามารถทำให้มันยาวขึ้นได้ ดังนั้นหลอดเลือดเทียมสามารถอยู่ในต้นขาหรือแม้กระทั่งที่คอ ('การโยงสร้อยคอ')
การเข้าถึงแบบ AV fistulas มีความเข้าใจง่ายและอยู่รอดมากกว่าการเข้าถึงแบบสายสวนหรือการพ่วงหลอดเลือดดำ มันยังสร้างภาวะแทรกซ้อนน้อยกว่าอีกด้วย ด้วยเหตุนี้ศูนย์การทำ Medicare และ Medicaid (CMS) ได้มีการจัดตั้งการริเริ่มการทำ fistula ครั้งแรก[6] เป้าหมายก็เพื่อเพิ่มการใช้ fistulas AV ในผู้ป่วยที่ต้องฟอกไต
มีงานวิจัยอย่างต่อเนื่องเพื่อทำให้หลอดเลือดด้วยวิธีชีววิศวกรรม ซึ่งอาจจะมีความสำคัญอันยิ่งใหญ่ในการทำ AV fistulas สำหรับผู้ป่วยในการฟอกเลือดที่ไม่มีหลอดเลือดที่ดีสำหรับการทำแม้เพียงจุดหนึ่ง มันเกี่ยวข้องกับการเลี้ยงเซลล์ที่ผลิตคอลลาเจนและโปรตีนอื่น ๆ ในหลอด micromesh ที่ย่อยสลายได้ ตามมาด้วยการกำจัดเซลล์เหล่านั้นเพื่อทำ 'หลอดเลือด' ให้สามารถจัดเก็บไว้ได้ในตู้เย็น[7]
ส่วนนี้ไม่มีการอ้างอิงจากเอกสารอ้างอิงหรือแหล่งข้อมูล โปรดช่วยพัฒนาส่วนนี้โดยเพิ่มแหล่งข้อมูลน่าเชื่อถือ เนื้อหาที่ไม่มีการอ้างอิงอาจถูกคัดค้านหรือนำออก |

เครื่องฟอกเลือดจะปั๊มเลือดของผู้ป่วยและสารฟอก (dialysate) เข้าไปในตัวฟอก (dialyzer) เครื่องฟอกไตใหม่ล่าสุดในตลาดใช้ระบบคอมพิวเตอร์และมีการตรวจสอบอย่างต่อเนื่องของพารามิเตอร์ที่วิกฤตต่อความปลอดภัย เช่นอัตราการไหลของเลือดและสารฟอก; ความสามารถในการนำไฟฟ้า (conductivity) ของสารละลายการฟอกเลือด, อุณหภูมิและค่าพีเอช; และการวิเคราะห์สารฟอกเพื่อหาหลักฐานของการรั่วไหลของเลือดหรือการปรากฏตัวของอากาศ ค่าใด ๆ ที่อ่านได้ค่าผิดจากช่วงปกติจะสร้างเสียงแจ้งเตือนให้กับช่างเทคนิคผู้ดูแลผู้ป่วย ผู้ผลิตเครื่องฟอกไตรวมถึง บริษัท เช่น Nipro, Fresenius, Gambro แบ็กซ์เตอร์, B. Braun, NxStage และ Bellco

ระบบการทำน้ำให้บริสุทธิ์มีความสำคัญอย่างมากสำหรับการฟอกเลือด เนื่องจากผู้ป่วยที่ทำการฟอกเลือดต้องสัมผัสกับปริมาณมหาศาลของน้ำเมื่อผสมกับสารฟอกเข้มข้นเพื่อทำเป็นสารละลาย แม้เพียงเศษของสารปนเปื้อนหรือเชื้อแบคทีเรียก็สามารถเล็ดลอดเข้าสู่กระแสเลือดของผู้ป่วยได้ เนื่องจากไตเกิดความเสียหายจึงไม่สามารถปฏิบัติหน้าที่ตามวัตถุประสงค์ของการกำจัดสิ่งสกปรก ไอออนต่าง ๆ ที่เข้าสู่กระแสเลือดผ่านทางน้ำสามารถเติบโตขึ้นให้อยู่ในระดับที่เป็นอันตรายและก่อให้เกิดอาการต่าง ๆ นานาหรือเสียชีวิตได้ อะลูมิเนียม, คลอราไมน์, ฟลูออไรด์, ทองแดงและสังกะสีรวมทั้งเศษและพิษของแบคทีเรียทั้งหมดนี้สามารถก่อให้เกิดปัญหาได้
ด้วยเหตุนี้ น้ำที่ใช้ในการฟอกเลือดจะต้องทำให้บริสุทธิ์อย่างรอบคอบก่อนการใช้งาน ตอนแรกมันจะถูกกรองและปรับอุณหภูมิและค่าพีเอชจะได้รับการแก้ไขโดยการเพิ่มกรดหรือด่าง จากนั้นก็จะมีการปรับให้นุ่มลง ต่อไปน้ำจะวิ่งผ่านแทงค์ผงถ่านเพื่อดูดซับสารปนเปื้อนอินทรีย์ การทำให้บริสุทธ์ขั้นต้นก็จะทำโดยการบังคับให้น้ำไหลผ่านเมมเบรนที่มีรูขนาดเล็กมากที่เรียกว่าเมมเบรนออสโมซิสย้อนกลับ (reverse osmosis membrane) ซึ่งจะยอมให้น้ำผ่านไปได้ แต่จะขวางกั้นสิ่งเจือปนที่แม้มีจะขนาดเล็กมากเช่นอิเล็กโทรไลท์ การกำจัดขั้นตอนสุดท้ายของอิเล็กโทรไลท์ส่วนที่เหลือจะทำโดยปล่อยน้ำผ่านถังที่มีเรซินที่ทำหน้าที่แลกเปลี่ยนไอออนซึ่งไอออนลบและไอออนบวกที่เหลือจะถูกแทนที่ด้วยโมเลกุลของไฮดรอกซิลและไฮโดรเจนตามลำดับ สิ่งที่ได้คิอน้ำบริสุทธิ์ยิ่งยวด
แม้ว่าระดับความบริสุทธิ์ของน้ำนี้อาจจะไม่เพียงพอ แนวโน้มเมื่อเร็ว ๆ นี้คือการข้ามขั้นตอนการทำน้ำให้บริสุทธิ์ขั้นสุดท้าย (หลังจากผสมกับสารฟอกเลือดเข้มข้น) โดยใช้เมมเบรนที่เป็นตัวฟอกในตัว (dialyzer membrane) ซึ่งนี้จะเป็นอีกขั้นหนึ่งของการป้องกันโดยการเอาสิ่งสกปรกออก, โดยเฉพาะอย่างยิ่งสิ่งที่เป็นแหล่งกำเนิดของเชื้อแบคทีเรียที่อาจมีการสะสมในน้ำหลังจากไหลผ่านระบบทำน้ำให้บริสุทธิ์เดิม
เมื่อน้ำบริสุทธิ์ผสมกับสารฟอกเลิอดเข้มข้น ความนำไฟฟ้าของน้ำจะเพิ่มขึ้นเนื่องจากน้ำที่มีประจุไอออนจะนำไฟฟ้าได้ดี ในระหว่างการฟอกเลือด การนำไฟฟ้าของสารละลายการฟอกเลือดจะถูกตรวจสอบอย่างต่อเนื่องเพื่อให้แน่ใจว่าน้ำและสารฟอกเลือดเข้มข้นทำการผสมกันในสัดส่วนที่เหมาะสม ถ้าสารละลายการฟอกเลือดมีความเข้มข้นมากเกินไปหรือเจือจางมากเกินไปอาจทำให้เกิดปัญหาทางคลินิกที่รุนแรง
ตัวฟอกเลือด (dialyzer) เป็นอุปกรณ์ในเครื่องฟอกเลือดที่ทำการกรองเลือดจริง ๆ เกือบทั้งหมดที่ใช้อยู่ในปัจจุบันเป็นแแบบไฟเบอร์กลวงมัดเป็นรูปทรงกระบอกที่มีผนังเป็นเยื่อกึ่งน้ำซึมได้ (semi-permeable membrane) วางอยู่ที่ปลายแต่ละด้านของทรงกระบอกประกอบกันเป็นอุปกรณ์คล้ายกะเปาะ (ด้วยกาวชนิดหนึ่ง) จากนั้นอุปกรณ๋นี้จะถูกใส่ลงไปในกระบอกพลาสติกใสที่มีช่องเปิดสี่ช่อง สองช่องเปิดจะเป็นพอร์ตเลือดอยู่ที่แต่ละปลายของกระบอกซึ่งจะสื่อสารกับแต่ละปลายของมัดเส้นใยกลวง ซึ่งจะใช้เป็น "ช่องเลือด" ของตัวฟอก อีกสองพอร์ตจะถูกตัดเข้าด้านข้างของกระบอกซึ่งจะสื่อสารกับช่องว่างรอบเส้นใยกลวงที่เรียกว่า "ช่องสารฟอก" (dialysate compartment) เลือดจะสูบผ่านทางมัดของหลอดบางมาก ๆ ที่มีรูปร่างเหมือนเส้นเลือดฝอย และสารฟอกจะถูกสูบผ่านที่ว่างรอบเส้นใย ความดันไล่ระดับถูกใส่เข้าไปเมื่อจะย้ายของเหลวจากเลือดไปยังช่องสารฟอก
เยื่อกรองในตัวฟอกเลือดจะมีรูพรุนขนาดเล็กหลายขนาด รูพรุนที่มีขนาดเล็กเรียกว่า "ฟลักซ์ต่ำ" และรูพรุนที่มีขนาดใหญ่เรียกว่า "ฟลักซ์สูง" โมเลกุลขนาดใหญ่เช่นเบต้า-2-microglobulin ไม่ถูกลบออกเลยเมื่อใช้ตัวฟอกแบบฟลักซ์ต่ำ; ล่าสุดมีแนวโน้มที่จะใช้ตัวฟอกแบบฟลักซ์สูง อย่างไรก็ตาม ตัวฟอกดังกล่าวต้องการเครื่องฟอกไตสมัยใหม่ที่มีสารละลายฟอกเลือดคุณภาพสูงเพื่อควบคุมอัตราการกำจัดของเหลวอย่างเหมาะสมและเพื่อป้องกันสิ่งสกปรกจากสารละลายการฟอกไตที่อาจไหลกลับผ่านเยื่อกรองเข้าไปในผู้ป่วยได้
เยื่อกรองในตัวฟอกเลือดเคยทำจากเซลลูโลสเป็นหลัก (มาจากผ้าฝ้าย) พื้นผิวของเยื่อดังกล่าวไม่ใช่วัสดุชีวะ (biocompatible) อย่างมากเพราะกลุ่มไฮดรอกซิลที่ผ่านการสัมผัสแล้วจะเปิดใช้งานระบบเสริมให้กับเลือดที่กำลังผ่านเยิ่อกรอง ดังนั้นเยื่อเซลลูโลส "ที่ไม่ได้ทดแทน" ขั้นพื้นฐานได้มีการปรับเปลี่ยน หนึ่งในการเปลี่ยนแปลงนั้นก็เพื่อจะห่อหุ้มกลุ่มไฮดรอกซิลเหล่านี้ด้วยกลุ่มแอซิเตต (เซลลูโลสแอซิเตต); อีกการเปลี่ยนแปลงหนึ่งคือเพื่อผสมในสารบางอย่างที่จะยับยั้งการเปิดใช้งานระบบเสริมที่พื้นผิวของเยื่อกรอง(เซลลูโลสที่ผ่านการปรับเปลี่ยน) เยื่อกรอง "เซลลูโลสที่ไม่ถูกแทนที่" ต้นฉบับไม่ได้มีการใช้อย่างกว้างขวางอีกต่อไปในขณะที่เซลลูโลสแอซิเตตและตัวฟอกเลือดที่ทำจากเซลลูโลสที่ผ่านการดัดแปลงยังคงมีการใช้งาน เยื่อกรองแบบเซลลูโลสสามารถทำให้เป็นแบบฟลักซ์ต่ำหรือฟลักซ์สูงได้ขึ้นอยู่กับขนาดรูพรุนของมัน
อีกกลุ่มของเยื่อกรองจะทำจากวัสดุสังเคราะห์โดยใช้สารโพลีเมอร์ เช่น polyarylethersulfone, polyamide, polyvinylpyrrolidone, โพลีคาร์บอเนต, และ polyacrylonitrile เยื่อกรองสังเคราะห์เหล่านี้เปิดใช้งานระบบเสริมในระดับที่น้อยกว่าเยื่อกรองเซลลูโลสที่ไม่ถูกแทนที่ เยื่อกรองสังเคราะห์สามารถทำเป็นแบบฟลักซ์ต่ำหรือฟลักซ์สูงได้ แต่ส่วนใหญ่จะเป็นแบบฟลักซ์สูง
นาโนเทคโนโลยีจะถูกใช้ในบางกรณีของเยื่อกรองแบบฟลักซ์สูงล่าสุดเพิ่อสร้างขนาดรูที่มีขนาดเดียว เป้าหมายของเยื่อกรองฟลักซ์สูงคือการให้ผ่านโมเลกุลที่ค่อนข้างใหญ่ เช่นเบต้า-2-ไมโครกลอบูลิน (MW 11,600 ดาลตัน) แต่ไม่ให้ผ่านอัลบูมิน (MW ~66,400 ดาลตัน) ทุกเยื่อกรองจะมีรูพรุนในช่วงขนาดหนึ่ง เมื่อขนาดรูพรุนเพิ่มขึ้น บางตัวกรองแบบฟลักซ์สูงเริ่มที่จะยอมให้อัลบูมินผ่านออกจากเลือดเข้าสู่ตัวฟอก นี่คือกรณีที่ไม่พึงประสงค์ ถึงแม้ว่าบางแนวคิดถือว่าการเอาอัลบูมินออกบ้างอาจจะเป็นประโยชน์ในแง่ของการเอาสารพิษที่มีโปรตีนออก (protein-bound uremic toxins)
การใช้ตัวฟอกแบบฟลักซ์สูงจะช่วยเพิ่มผลลัพธ์ในการรักษาให้กับผู้ป่วยหรือไม่ยังเป็นที่ถกเถียงกันอยู่บ้าง แต่การศึกษาที่สำคัญหลายครั้งบอกว่ามันมีประโยชน์ทางคลินิก การทดสอบการฟอกโดยการอุดหนุนทางการเงินจาก NIH ได้เปรียบเทียบการรอดชีวืตและการรักษาในโรงพยาบาลของผู้ป่วยล้างไตแบบสุ่มเมื่อใช้เยื่อกรองทั้งแบบฟลักซ์ต่ำหรือแบบฟลักซ์สูง แม้ว่าผลลัพธ์เบื้องต้น (ทุกสาเหตุการตาย) ไม่ถึงจุดทางสถิติที่มีนัยสำคัญในกลุ่มสุ่มที่ใช้เยื่อกรองแบบฟลักซ์สูง ผลลัพธ์รองหลายตัวจะดีกว่าในกลุ่มฟลักซ์สูง[8][9] การวิเคราะห์ของ Cochrane ที่ผ่านมาได้ข้อสรุปว่า การเลือกเยื่อกรองมีผลลลัพธ์ที่ยังไม่ได้แสดงให้เห็นประโยชน์[10] การทดลองแบบสุ่มด้วยความร่วมมือจากยุโรปที่เรียกว่า การศึกษา MPO (Membrane Permeabilities Outcomes)[11] เป็นการเปรียบเทียบอัตราการเสียชีวิตในผู้ป่วยที่เพิ่งเริ่มต้นล้างไตโดยใช้เยื่อกรองฟลักซ์สูงหรือฟลักซ์ต่ำ ได้พบแนวโน้มที่ไม่มีนัยสำคัญสำหรับการอยู่รอดที่ดีขึ้นในผู้ป่วยที่ใช้เยื่อกรองแบบฟลักซ์สูงและอัตราการรอดชีวิตในผู้ป่วยที่มีระดับแอลบูมินในซีรั่มที่ต่ำกว่าหรือในผู้ป่วยไดที่มาจากโรคเบาหวาน
นอกจากนี้เยื่อกรองสำหรับฟอกเลือดที่มีฟลักซ์สูงและ / หรือการฟอกเลือดแบบออนไลน์ไม่สม่ำเสมอ (intermittent on-line hemodiafiltration (IHDF)) ยังอาจจะเป็นประโยชน์ในการลดภาวะแทรกซ้อนของการสะสมเบต้า 2 microglobulin เนื่องจากเบต้า-2-microglobulin เป็นโมเลกุลขนาดใหญ่ที่มีน้ำหนักโมเลกุลประมาณ 11,600 ดาลตัน มันจึงไม่ผ่านเยื่อกรองฟอกเลือดแบบฟลักซ์ต่ำเลย Beta-2-M จะถูกกรองออกด้วยตัวฟอกเลือดฟลักซสูง และจะถูกกรองออกได้อย่างมีประสิทธิภาพมากยิ่งกว่าด้วย IHDF หลังจากหลายปี (โดยปกติอย่างน้อย 5–7 ปี) ่ของการสะสมของเบต้า-2-M ผู้ป่วยฟอกเลือดเริ่มที่จะพัฒนาภาวะแทรกซ้อน ได้แก่โรคอุโมงค์ carpal, ซีสต์ของกระดูก และการสะสมของ amyloid นี้ในข้อต่อและเนื้อเยื่ออื่น ๆ Beta-2-M amyloidosis สามารถทำให้เกิดภาวะแทรกซ้อนที่รุนแรงมากรวมทั้ง spondyloarthropathy และมักจะมีความเกี่ยวข้องกับปัญหาข้อต่อที่หัวไหล่ การศึกษาแบบสังเกตการณ์จากยุโรปและญี่ปุ่นได้แนะนำว่าการใช้เยื่อกรองฟลักซ์สูงในโหมดการฟอกเลือดหรือ IHDF ช่วยลดภาวะแทรกซ้อนจากเบต้า-2-M ในการเปรียบเทียบกับการฟอกเลือดปกติโดยใช้เยื่อกรองฟลักซ์ต่ำ[12][13][14][15][16]
ตัวกรองมีหลายขนาดที่แตกต่างกันมาก ตัวกรองขนาดใหญ่มีพื้นที่เยื่อกรอง (A) ขนาดใหญ่เพื่อกรองสารละลายที่ใหญ่กว่า โดยเฉพาะอย่างยิ่งที่อัตราการไหลของเลือดสูง นอกจากนี้ยังขึ้นอยู่กับสัมประสิทธิ์การซึมผ่าน K0 ของเยื่อกรองสำหรับตัวทำละลายนั้น ๆ ดังนั้นประสิทธิภาพของตัวฟอกมักจะแสดงค่าเป็น K0A หรือผลคูณของค่าสัมประสิทธิ์การซึมผ่านกับพื้นที่ของเยื่อกรอง ตัวกรองส่วนใหญ่จะมีพื้นที่ผิวของเยื่อกรองอยู่ที่ 0.8–2.2 ตารางเมตรและค่าของ K0A อยู่ที่ตั้งแต่ประมาณ 500–1,500 มิลลิลิตร/นาที ค่าของ K0A อยู่ในรูปมิลลิลิตร/นาทีสามารถจะคิดว่าเป็นระยะห่างสูงสุดของตัวกรองที่อัตราการไหลของเลือดและสารฟอกที่สูงมาก
ตัวฟอกอาจจะถูกนำไปทิ้งหลังการบำบัดในแต่ละครั้งหรือถูกนำกลับมาใช้ใหม่ การนำมาใช้ใหม่ต้องมีขั้นตอนที่กว้างขวางของการฆ่าเชื้อโรคในระดับที่สูง ตัวกรองที่นำกลับมาใช้ใหม่ไม่ควรนำมาใช้ร่วมกับผู้ป่วยรายอื่น มีความขัดแย้งแต่แรกเกี่ยวกับว่าการนำตัวฟอกมาใช้ใหม่จะทำให้ผู้ป่วยได้ผลลัพธ์แย่ลงกว่าเดิมหรือไม่ ฉันทามติในวันนี้คือการนำตัวฟอกกลับมาใช้ใหม่ถ้าทำอย่างรอบคอบและถูกต้องจะก่อให้เกิดผลลัพธ์ที่คล้ายกับการใช้งานตัวฟอกแบบใช้แล้วทิ้ง[17]
การนำตัวฟอกกลับมาใช้ใหม่ได้มีการปฏิบัติกันมาตั้งแต่มีการประดิษฐ์ตัวฟอก การปฏิบัตินี้รวมถึงการทำความสะอาดตัวฟอกใช้แล้วเพื่อนำกลับมาใช้กับผู้ป่วยรายเดิมอีกหลายครั้ง คลินิกฟอกไตจะนำตัวฟอกกลับมาใช้ใหม่เพื่อความประหยัดและลดค่าใช้จ่าย เพราะการใช้ "แบบครั้งเดียวทิ้ง" อาจมีราคาแพงและสิ้นเปลืองอย่างมาก ตัวฟอกที่มีการใช้เพียงครั้งเดียวแล้วโยนทิ้งจะสร้างของเสียชีวภาพทางการแพทย์เป็นจำนวนมากโดยไม่มีการประหยัดค่าใช้จ่าย ถ้าทำถูกต้อง ตัวฟอกที่นำกลับมาใช้ใหม่จะปลอดภัยมากสำหรับผู้ป่วยล้างไต
มีสองวิธีในการนำตัวฟอกกลับมาใช้ใหม่ คือแบบทำด้วยมือกับแบบอัตโนมัติ การนำกลับมาใช้ใหม่ด้วยมือจะเกี่ยวกับการทำความสะอาดตัวฟอกด้วยมือ ตัวฟอกเป็นแบบกึ่งถอดได้แล้วถ่ายทิ้งซ้ำแล้วซ้ำอีกก่อนที่จะถูกล้างด้วยน้ำ หลังจากนั้นมันจะถูกเก็บไว้ร่วมกับยาฆ่าเชื้อแบบของเหลว (PAA) เป็นเวลากว่า 18 ชั่วโมงก่อนจะนำมาใช้งานครั้งต่อไป แม้ว่าหลายคลินิกนอกสหรัฐอเมริกาจะใช้วิธีการนี ้คลินิกบางแห่งจะเปลี่ยนไปใช้กระบวนการที่อัตโนมัติ/คล่องตัวมากขึ้นตามความก้าวหน้าของการปฏิบัติการฟอกไต กระบวนการใหม่ของการใช้ซ้ำแบบอัตโนมัติจะทำโดยวิธีการของอุปกรณ์ทางการแพทย์ซึ่งเริ่มขึ้นในช่วงต้นทศวรรษ 1980 อุปกรณ์เหล่านี้มีประโยชน์ต่อคลินิกฟอกไตที่นำมาใช้ในการปฏิบัติ - โดยเฉพาะอย่างยิ่งสำหรับหน่วยงานทางคลินิกฟอกไตขนาดใหญ่ - เพราะอุปกรณ์ยอมให้มีวงรอบการทำงานต่อวันได้หลายรอบ ตอนแรกตัวฟอกจะถูกทำความสะอาดล่วงหน้าโดยช่างเทคนิค จากนั้นการความสะอาดจะทำโดยอัตโนมัติผ่านกระบวนการเป็นขั้นเป็นตอนเป็นรอบจนในที่สุดมันก็จะถูกเติมเต็มด้วยยาฆ่าเชื้อของเหลวในการจัดเก็บ แม้ว่าการนำมาใช้ใหม่โดยอัตโนมัติจะมีประสิทธิภาพมากกว่าการนำมาใช้ใหม่ด้วยมือ เทคโนโลยีใหม่ได้ก่อให้เกิดความก้าวหน้ามากยิ่งขึ้นในกระบวนการของการที่นำมาใช้ เมื่อนำกลับมาใช้มากกว่า 15 ครั้งด้วยวิธีการปัจจุบัน ตัวฟอกอาจสูญเสีย B2M, โมเลกุลขนาดกลางและความสมบูรณ์ของโครงสร้างรูพรุนของเส้นใย ซึ่งมีศักยภาพในการลดประสิทธิภาพของเซสชั่นการฟอกเลือดของผู้ป่วย ในขณะนี้คือปี ค.ศ. 2010 เทคโนโลยีใหม่และการประมวลผลที่สูงขึ้นได้พิสูจน์ความสามารถในการกำจัดขั้นตอนการทำความสะอาด่วงหน้าโดยสิ้นเชิงและยังได้พิสูจน์แล้วว่ามีศักยภาพในการฟื้นฟูฟังก์ชันใหม่ทั้งหมด (เรียกคืนอย่างเต็มที่) ของตัวฟอกให้อยู่ในระดับที่ประมาณเทียบเท่ากับการ ใช้ครั้งเดียวทิ้งมากกว่า 30 รอบ[18] เนื่องจากอัตราการเบิกเงินคืนจากค่าใช้จ่ายทางการแพทย์เริ่มลดลงมากยิ่งขึ้น, คลินิกฟอกไตจำนวนมากได้มีการดำเนินงานอย่างมีประสิทธิภาพอย่างต่อเนื่องด้วยโปรแกรมที่นำกลับมาใช้ใหม่โดยเฉพาะอย่างยิ่งเนื่องจากกระบวนการมีความง่ายและคล่องตัวมากขึ้นกว่าแต่ก่อน

ปรับจากคำแนะนำเพื่อปฏิบัติการพยาบาลด้านวักกวิทยา(เกี่ยวกับไต)ที่พัฒนาโดยสมาคมโรคไตและเทคโนโลยีแคนาดา (CANNT) ตามหลักฐานและแนวทางปฏิบัติที่มีที่ดีที่สุดทางคลินิกพยาบาลโรคไต ควรดำเนินการดังนี้[19]
การเข้าถึงหลอดเลือดเพื่อการฟอกเลือด: ทำการประเมินจุดเชื่อมต่อ/จุดพ่วงหลอดเลือดและแขนก่อนหน้า และหลังการฟอกเลือดแต่ละครั้งหรือทุกกะ: การไหลเข้าออกช่องผ่าน ภาวะแทรกซ้อน ประเมินภาวะแทรกซ้อนของการใส่สายสวนหลอดเลือดดำส่วนกลาง: ตำแหน่งปลายเจาะ, แต่ละปลาย เอกสารประกอบภาวะแทรกซ้อนและแจ้งให้ผู้ให้บริการดูแลสุขภาพที่เหมาะสมเกี่ยวกับความกังวลใด ๆ ให้ความรู้แก่ผู้ป่วยที่มีการทำความสะอาดที่เหมาะสมของจุดเชื่อม/จุดพ่วง และตำแหน่งขาออก; กับการรับรู้และการรายงานอาการของการติดเชื้อและภาวะแทรกซ้อน
ความเพียงพอในการฟอกเลือด: ประเมินผู้ป่วยอย่างต่อเนื่องสำหรับอาการของการฟอกเลือดที่ไม่เพียงพอ ประเมินสาเหตุของการฟอกเลือดที่ไม่เพียงพอ ให้ความรู้แก่ผู้ป่วยเกี่ยวกับความสำคัญของการได้รับการฟอกไตที่เพียงพอ
การบำบัดและภาวะแทรกซ้อนของการฟอกเลือด: ดำเนินการประเมินทางกายภาพตั้งแต่หัวจรดเท้าก่อน ระหว่างและหลังการฟอกเลือดเพื่อหาภาวะแทรกซ้อนที่เกี่ยวข้องและความปลอดภัยของการเข้าถึงหลอดเลือด ยืนยันและส่งมอบใบสั่งแพทย์เพื่อการฟอกเลือดหลังจากการทบทวนผลการทดลองล่าสุด ให้ความเห็นถึงความกังวลใด ๆ ของผู้ป่วยและให้ความรู้แก่ผู้ป่วยเมื่อเห็นช่องว่างการพัฒนา
การบริหารจัดการด้านการแพทย์และการปฏิบัติเพื่อควบคุมการติดเชื้อ: ทำงานร่วมกับผู้ป่วยเพื่อพัฒนาระบบการให้การรักษา ปฏิบัติตามแนวทางควบคุมการติดเชื้อตามหลักปฏิบัติ
การฟอกเลือดเป็นหนึ่งในขั้นตอนการดำเนินการที่ธรรมดาที่สุดในโรงพยาบาลของสหรัฐในปี ค.ศ. 2011 เกิดขึ้นในการเข้าพักในรพ. 909,000 ราย (อัตราการเข้าพัก 29 ต่อประชากร 10,000) เพิ่มขึ้นร้อยละ 68 จากปี ค.ศ. 1997 เมื่อมีการเข้าพักเพียง 473,000 รายในขณะนั้น การฟอกเลือดเป็นขั้นตอนลำดับที่ห้าที่พบมากที่สุดสำหรับผู้ป่วยที่อายุ 45–64 ปี[20]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.