Oksonijumski jon
From Wikipedia, the free encyclopedia
From Wikipedia, the free encyclopedia
U hemiji, oksonijumski jon je svaki kiseonični katjon sa tri veze.[1] Najjednostavniji oksonijum jon je hidronijum joon H3O+. Još jedna klasa oksonijum jona koja se često sreće u organskoj hemiji su oksokarbenijum joni, koji se dobijaju protonacijom ili alkilacijom karbonilne grupe, e.g. R−C=O+−R′ koja formira rezonantnu strukturu sa punopravnom karbokatjonom R−C+−O−R′ i stoga je posebno stabilna:
Postoje stabilne alkiloksonijum soli; one se ekstenzivno koriste kao alkilirajući agensi. Na primer, trietiloksonijum tetrafluoroborat (Et
3O+
)(BF−
4) je bela kristalna čvrsta materija. Taj materijal je moćan etilirajući agens. On se može na primer koristiti u formiranju etil estara kad uslovi nisu povoljni za tradicionalnu Fišerovu esterifikaciju.[2] On se isto tako koristi za pripremu enolnih etara i srodnih funkcionalnih grupa.[3][4]
 | 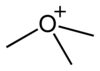 |  |  |
oksonijum jon | trimetiloksonijum katjona | trimetiloksonijuma | trimetiloksonijuma |
Drugi hidrougljenični oksonijumski joni se formiraju protonacijom ili alkilacijom alkohola ili etara (R−C−O+
−R
1R
2). U kiselim sredinama, oksonijumska funkcionalna grupa formirana protonacijom alkohola može da bude odlazeća grupa u reakciji E2 eliminacije, zato što nakon primanja elektrona, ona postaje molekul vode. Produkt je alken. Ekstremna kiselost, toplota i dehidratacioni uslovi su obično neophodni.
Oksatrihinan i oksatrihinacen su obično stabilni oksonijumski joni. Prvi je opisan 2008. goine. Oksatrihinan ne reaguje sa proključalom vodom ili sa alkoholima, tiolima, halidnim jonima, ili aminima, mada on reaguje sa jačim nukleofilima kao što su hidroksid, cijanid, i azid.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.