Кухињска со
Хемијско једињење From Wikipedia, the free encyclopedia
Remove ads
Кухињска со,[10] хемијски натријум-хлорид (молекулска формула ) је једно од најраспрострањенијих хемијских једињења у природи. Натријум хлорид је бела кристална супстанца, веома добро растворљива у води, ипак са малом максималном концентрацијом. Натријум хлорид спада у ред најзначајнијих једињења у хемијској индустрији и извор је сланости морске воде. Молекул натријум хлорида се састоји од једног атома натријума и једног атома хлора. Молекулска маса кухињске соли је 58.4 u. Температура топљења натријум хлорида износи 801 , а температура кључања 1465 .
Remove ads
Човек често користи кухињску со у својој исхрани као зачин или као средство које утиче на квалитет и брзину припремања хране. Натријум хлорид је со која је најодговорнија за сланост морске воде и ванћелијске течности многих вишећелијских организама. У свом јестивом облику кухињске соли уобичајено се користи као конзерванс и зачин за храну. Велике количине натријум хлорида користе се у многим индустријским процесима, а он је главни извор једињења натријума и хлора, која се користе као сировине за даље хемијске синтезе. Друга велика примена натријум хлорида је за одлеђивање путева при нискотемпературним временским приликама.
Remove ads
Биолошки значај
Кухињска со је главни извор јона Na+ и Cl- за људе и животиње. Јони Na+ имају кључну улогу у многим физиолошким процесима од одржања сталног крвног притиска до одржања делатности нервног система. Зато је уношење кухињске соли неопходно за живот.
Дневне потребе за њом износе око 50 али у данашњим условима уноси неколико пута више. Оптимална количина од 50 соли налази се у једној векни обичног белог хлеба.
Претпоставља се да прекомерна употреба соли може да изазове појаву неких обољења.
Remove ads
Својства и распрострањеност
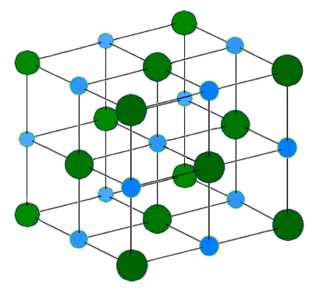

Со је доступна у облику прозирних кристала добро растворних у води, релативне молекулске масе 58,4 . Привлачне силе међу јонима у кристалној решетки су јаке, те због јаке јонске везе између јона натријума и хлора, тачка топљења је релативно висока 801 °C, а тачка кључања је 1465 °C.
У природи је со врло распрострањена и најраширеније је једињење натријума, а њен најважнији извор је вероватно морска вода у којој је њен масени удео око 2,8 - 3%. У Земљиној кори налази се у наслагама као камена со, халит, а у мањим количинама је има у сваком тлу.
Чист натријум хлорид је безбојни јонски кристал сланог укуса. Он кристализира у кубичном систему. Градивне јединице кристалне структуре су натријумови и хлоридни јони. Кристал је састављен од равно центрираних структура натријумових и хлоридних јона међусобно помакнутих за половину дужине брида елементарне ћелије. Координациони број натријумовог и хлоридног јона је шест. За такав је координациони број најчешћи октаедарски просторни распоред јона. Кухињска со се кристализује у безбојне коцке, и понекад у октаедре.
Снижење тачке смрзавања зависи од удела растворене материје у раствору; w() 10% раствор има тачку топљења од -7,4 °C, а 20%-ни раствор -14,5 °C. При нижим температура (-10 °C) из водених раствора излучује се у облику дихидрата () који при 0,15 °C прелази у безводну со. Натријум хлорид (употребљаван као кухињска со), је често влажан због присуства магнезијум хлорида () или магнезијум сулфата (4), који су хигроскопни. Чист натријум хлорид није хигроскопан. Он се добро раствара у поларним растварачима као што су: вода, метанол, етанол и течни амонијак; а апсолутна вредност енталпије растварања је јако мала. При растварању се разграђује кристална решетка.
У 100 воде при 50 °C може се растворити 39 . Једна литра морске воде садржи 10,5 натријумових хона и 19,0 хлорних јона. Енталпија растварања натријум хлорида је врло мала (4 −1), што показује да се растворљивост неће битно променити повишењем температуре, за разлику од неких других соли. То је разлог што је масени удео натријум хлорида у мору релативно сталан, око 2,8% без обзира на климатске услове;
Иако је водени раствор натријум хлорида неутралан, он због активирајућег деловања хлоридних јона делује корозивно (посебно ако садржи кисеоник из ваздуха).
У литри морске воде има 10,6 натријумових и 0,38 калијумових јона. Будући да је масени удео натријума и калијума у Земљиној кори готово једнак, велика се разлика њихових концентрација у морској води може се протумачити тиме што биљке из вода које продиру у тло вежу претежно калијумове јоне.
Со је неопходна у људској и животињској прехрани. У живом је организму важан однос концентрације (+) унутар и изван ћелије ( пумпа). Ако се равнотежа тих јона поремети, долази до поремећаја рада срца, метаболизма угљених хидрата, те подражљивости и контракције мишића. Натријум хлорид је потребан и неким биљкама које расту на обалама мора (халофите).
Remove ads
Производња
Натријум хлорид се може синтетисати по реакцији:
Алтернативно, може се излучити из природних извора као што су море, слана језера, дубинске наслаге слане воде, или се копа као минерал. Кухињска со се добија из морске воде (велике количине се налазе растворене у мору (просечно је = 2,7%), и из великих дебелих наслага као камена со, као остатак праисторијских мора која су се исушила у прошлим геолошким периодима.
Из природних се налазишта добија копањем и вађењем из рудника камене соли, црпљењем, концентрисањем и упаравањем слане воде из подземних наслага и упаравањем морске воде у плитким базенима.
Из природних налазишта натријум хлорид се добија на три начина:
- Рударским копањем добивају се блокови соли који се растварају за индустријске потребе, или се дробе и мељу за прехрану. Таква камена со обично је врло чиста и садржи само трагове магнезијума.
- Наслаге камене соли растварају се у води до засићења. Слана вода се црпи и упарава. Со кристализује у облику врло ситних кристала (варена сол). На тај начин добија се со у Тузли у Босни и Херцеговини. Ова со је поприлично чиста, али ипак садржи више нечистоћа (посебно магнезијума) од камене соли.
- Упаравањем морске воде (Нин, Паг, Стон). Како је морска вода богата натријум хлоридом, со се добива и упаравањем (у топлим крајевима) или смрзавањем (у хладним крајевима) морске воде у плитким базенима.
Морска со је најмање чиста и садржи прилично магнезијума (w() = 0,5 до 1,2%). Количина магнезијума у морској соли зависи од начина кристализације. Ако се кристализује из мање концентрованих раствора (26° ~ 1,219−3), со садржи врло мало магнезијума. Осим тога је важно да ли се со скупља свакога дана (Пиран) или једном годишње (Улцињ). Код свакодневне бербе садржај магнезијумових једињења у натријум хлориду је максималан (w() = 1,5%). Таква со је горка и врло хигроскопна. Велике количине соли троше се за људску и сточну храну. За људску храну обично је потребно со претходно јодирати.
Употребе
Поред познате домаће употребе соли, доминантније примене од око 250 мегатона годишње (према подацима из 2008) укључују хемикалије и средства за одлеђивање.[11]
Хемијска продукција
Со се користи директно или индиректно у производњи многих хемикалија, што конзумира већину светске производње.[12]
Хлоралкална индустрија
Со је полазна основа за хлоралкални процес, индустријски процес за производњу хлора и натријум хидроксида, према хемијској једначини
Ова електролиза се врши или у живиној ћелији, ћелији с дијафрагмом или мембранској ћелији. Свака од њих користи другачију методу за одвајање хлора од натријум хидроксида. Остале технологије су у развоју због велике потрошње енергије при електролизи, при чему мала побољшања ефикасности могу имати велике економске повраћаје. Неке примене хлора укључују ПВЦ, дезинфекциона средства и раствараче. Натријум хидроксид је сировина у индустрији папира, сапуна и алуминијума.
Стандард
Натријум-хлорид има међународни стандард који је креирала организација . Стандард је именован и обухвата стандардне поступке испитивања за хемијску анализу натријум хлорида. Наведене методе пружају поступке за анализу натријум хлорида како би се утврдило да ли је погодан за његову намеравану употребу и примену.
Омекшавање воде
Тврда вода садржи јоне калцијума и магнезијума који ометају дејство сапуна и доприносе накупљању каменца или филма алкалних наслага минерала у домаћинству и индустријској опреми и цевима. Комерцијалне и стамбене јединице за омекшавање воде користе јоноизмењивачке смоле за уклањање штетних јона који узрокују тврдоћу. Ове смоле се стварају и регенеришу коришћењем натријум хлорида.[11][12]
Друмска со

Друга велика примена соли је за уклањање леда и спречавање залеђивања путева, помоћу посуда за со, као користећи возила зимских служби. У ишчекивању сњежних падавина, путеви су оптимално припремају сланом водом (концентровани раствор соли у води), чиме се спречава везивање снежног леда за пут. Овај поступак спречава велику употребу соли након снежних падавина. За одлеђивање се користе смеше раствора соли и соли, каткад са додатним средствима као што су калцијум хлорид и/или магнезијум хлорид. Употреба соли или раствора соли постаје неефикасна испод −10 °C (14 °F).

Со за уклањање леда у Великој Британији углавном долази из једног рудника у Винсфорду у Чеширу. Пре дистрибуције она се меша са <100 ppm натријум фероцијанида као средства против згрудњавања, што омогућава каменој соли да слободно тече из носача за мрвљење упркос томе што је била складиштена пре употребе. Последњих година овај адитив се примењује и у кухињској соли. Остали адитиви су коришћени у друмској соли за смањење укупних трошкова. На пример, у САД нуспроизвод угљено хидратног раствора од прераде шећерне репе је мешан са каменом соли, јер је утврђено да приања за друмске површине око 40% боље од саме растресите камене соли. Пошто се дуже задржавао на путу, третман се није морао понављати неколико пута, штедећи време и новац.[12]
У техничком погледу физичке хемије, најмања тачка смрзавања смеше воде-соли је −21,12 °C (−6,02 °F) за 23,31 теж.% соли. Замрзавање у близини ове концентрације је међутим тако споро да се еутектичка тачка од −22,4 °C (−8,3 °F) може достићи са око 25 теж.% соли.[13]
Утицаји на животну средину
Друмска со завршава у слатководним масама и може наштетити воденим биљкама и животињама нарушавајући њихову способност осморегулације.[14] Свеприсутност соли представља проблем код било које обалске покровне примене, јер заробљене соли узрокују велике проблеме у адхезији. Поморске власти и градитељи бродова прате концентрацију соли на површинама током изградње. Максималне концентрације соли на површинама зависе од органа власти и типа примене. регулација се углавном користи и поставља ниво соли на максимално 50 2 растворљивих соли мерених као натријум хлорид. Ова мерења се врше Бресловим тестом. Салинизација (повећавање салинитета, или синдром салинизације свеже воде) и накнадно повећано испирање метала, трајни су проблем широм северноамеричких и европских слатководних рута.[15]
При одлеђивању аутопутева, со је била повезана са корозијом мостовских површина, моторних возила, арматурних шипки и жица, и незаштићених челичних конструкција које се користе у изградњи путева. Површинско отицање, прскање возила и деловање наноса ветра такође утичу на тло, вегетацију дуж путева и локалне површинске и подземне воде. Иако су пронађени докази о оптерећењу околине током вршне употребе соли, пролећне кише и одмрзавања обично разблажују концентрације натријума у подручју где је со примењена.[12] Једна студија из 2009. године утврдила је да се око 70% друмске соли која се примењује у метро подручју Минеаполис-Сент Пол задржава на локалном сливу.[16]
Замене
Неке агенције уместо цестовне соли су покушале примену пивског отпада, меласе и сока од цвекле.[17] Авио-компаније користе више гликола и шећера, него раствора на бази соли за одлеђивање.[18]
Remove ads
Види још
Референце
Литература
Спољашње везе
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads




