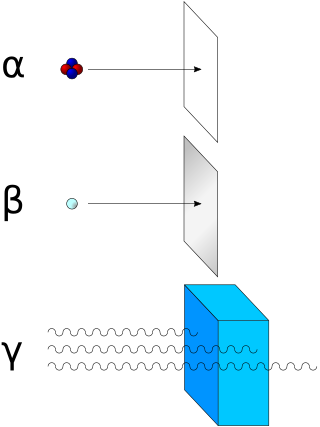
Алфа распад је облик радиоактивног распада у којем се атомско језгро избацивањем алфа честице (атомског језгра хелијума) преобраћа у језгро са масеним бројем, , мањим за 4 јединице и наелектрисањем, мањим за 2 јединице. Распад може бити приказан следећом схемом: где су и хемијски симболи родитеља, односно потомка, редни а масени број. На пример, распад уранијума () се представља нуклеарном реакцијом: што се пише и као: Или, распад радијума (): или : Поједностављени изрази у којима се наелектрисање језгра не појављује експлицитно чешће се користе јер на први поглед комплетне једначине изгледају по наелектрисањима неуравнотежене. У ствари, узмакло језгро потомка врло брзо губи своја два електрона а на неком другом месту заустављена алфа честица прима два електрона и прелази у неутрални атом хелијума. Дакле, у горњим реакцијама очувани су како бројеви нуклеона (неутронa, протона) тако и број електрона.)
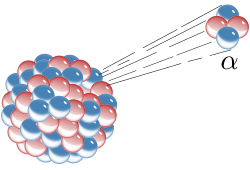



Алфа распад се у суштини може сматрати цепањем атомског језгра (нуклеарна фисија), где се језгро родитељ цепа на два потомка од којих је један хелијум. Алфа распад се одвија помоћу тунел ефекта. За разлику од бета распада, алфа распад се одвија под утицајем јаке силе. Алфа честице имају кинетичку енергију реда 5 (тј. ≈0,13% њихове тоталне енергије која износи 110 ) и брзину од 15.000 (што одговара брзини приближно 0,05c). Упркос томе, алфа честице се у ваздуху заустављају на путањи од неколико сантиметара. Због постојања алфа распада, скоро целокупна количина хелијума насталог на Земљи потиче из наслага минерала који садрже уранијум и торијум, а на површину излази као нуспроизвод у производњи природног (земног) гаса. Алфа распад честица је природан вид зрачења честица. Анализа је показала да је α-зрачење састављено од два протона и два неутрона (конфигурација хелијума). α-распад се јавља код елемената великог редног броја ( > 82). Настаје емисијом α-честица из језгра искључиво тунел ефектом. Енергије алфа честица имају дискретан спектар и тачно одређен спектар вредности енергија. Вредности енергија α-честица су реда величине неколико -а. Приликом емисије α-честице, језгро радиоактивног елемента (родитеља) је трансформисано у језгро другог елемента (потомка) чији је редни број мањи за два, а масени за четири.
До распада долази због нестабилности атомског језгра односно неуравнотеженог броја протона и неутрона у њему. Нека су атомска језгра природно нестабилна и распадају се у дужем или краћем временском интервалу (време полураспада), а нека стабилна атомска језгра могу постати нестабилна након што на њих делују честице велике енергије. Алфа распад се догађа најчешће код масивних језгара која имају превелик однос протона у односу на неутроне. Алфа честица с два протона и два неутрона је врло стабилна конфигурација нуклеона. Многа се језгра масивнија од олова (> 106 у или више од 106 атомских јединица масе) распадају овим распадом. Најмања атомска језгра која могу зрачити алфа-честице је телуријум (З = 52), који има атомску масу од 106 до 110. Код алфа распада атомска маса и редни бројеви језгра се мењају, што значи да атомско језгро која се распада и језгро настало тим распадом припадају различитим хемијским елементима, те стога, имају различита хемијска својства.[1]
Кад је однос неутрона и протона у атомском језгру одређених атома пренизак, они емитирају алфа-честицу како би успоставили равнотежу. На пример: полонијум-210 има 126 неутрона и 84 протона, што је однос од 1,50 према 1. Након радиоактивног распада емитовањем алфа честице, однос постаје 124 неутрона напрема 82 протона или 1,51 напрема 1. Будући да број протона у језгру одређује елемент, полонијум-210 након емисије алфа честице постаје олово-206 који је стабилан елемент.[2][3] Атоми који емитују алфа честице углавном су врло велики атоми, тј. имају високе атомске бројеве. Много је природних и вештачких радиоактивних елемената који емитују алфа честице. Природни извори алфа-честица имају атомски број најмање 82, уз неке изузетке. Најважнији алфа емитери су: америцијум-241 ( = 95), плутонијум-236 ( = 94), уранијум-238 ( = 92), торијум-232 ( = 90), радијум-226 ( = 88), радон-222 ( = 86). Алфа емитери су присутни у различитим количинама у готово свим стенама, тлу и води. Након емисије, алфа честице се због велике масе и електричног набоја крећу се релативно споро (отприлике 1/20 брзине светлости) и у ваздуху потроше сву енергију након неколико центиметара и тада вежу слободне електроне и постају хелијум.[4]
Својства алфа распада
Брзина и енергија алфа-честица
У погледу почетне брзине алфа честица, енергије, домета, апсорпције и продорности кроз разне материје, као и способности јонизације гасова, утврђено је да оне имају своје посебне особине, које зависе од природе радиоактивног елемента из којег потичу. Почетна брзина алфа-честица је различита за различите радиоактивне елементе и износи од 14 000 до 22 000 , што је око 5 до 7,5% брзине светлости. Кинетичка енергија алфа-честица зависи од природе радиоактивног елемента из којег потиче и креће се од 4 до 10 . У почетку се сматрало да све алфа честице, које емитују радиоактивни елементи, имају исту брзину, али су онда експерименти показали да један радиоактивни изотоп може да зрачи алфа честице различитих брзина или различитих кинетичких енергија. Тако је познато да радијум-226 зрачи алфа честице са 4 енергетске групе: 7,68 , 8,277 , 9,066 и 10,505 .
Домет и апсорпција алфа-честица
Ханс Гајгер је емпиријским путем утврдио зависност домета алфа честица, под стандардним притиском и температуром, од њихове почетне брзине. Такође је Гајгер, заједно с Џоном Наталом, пронашао везу између времена полураспада, односно константе распадања λ, неког радиоактивног елемента који зрачи алфа честице и њиховог домета у ваздуху, што се назива Гајгер-Наталов закон:
где је: λ - константа распадања (λ = 2/време полураспада), – атомски број, – укупна кинетичка енергија (алфа честице и атомског језгра из кога је настала), те a1 и a2 - константе.
С обзиром на време полураспада радиоактивних елемената, утврђено је да нестабилни атоми с кратким животом зраче алфа честице велике енергије, велике брзине и великог домета. Домет алфа честице се креће од 28 (торијум-232, време полураспада 1,39 x 10<суп>10</суп> година) до 86 (полонијум-212, време полураспада 3 x 10−7 секунди). Ни све алфа честице једног истог радиоактивног елемента немају исти домет. Генерално, од укупног броја алфа честица, највећи њихов део има исти домет, а мањи део има више снопова различитог домета. То значи, да се алфа честице, које емитује један исти извор, могу састојати из више група различитих брзина, односно енергија. Углавном се појављује спектар алфа честица, састављен од две или више одвојених енергетских група.
Иако алфа честице имају велику масу и енергију, ипак су њихови домети кратки, јер их хемијске материје кроз које пролазе заустављају. Ово заустављање настаје због међуделовања позитивно набијених алфа честица и негативних електрона из материја кроз које пролазе. При томе, електрони могу бити избачени из атома те материје, а потребну енергију даје алфа честица. Смањењем енергије алфа честице смањује се и њена брзина, а то омогућава да се електрони с њима састављају, па се тако добијају атоми хелијума, који су електрично неутрални. Ипак, при томе кретању настаје врло јака јонизација.[5]
Јонизацијско зрачење
Утврђено је да алфа честице које се зраче из разних радиоактивних елемената производе од 50 000 до 100 000 јонских парова, на један центиметар ваздуха, чиме настаје јонизујуће зрачење. Ако се направи дијаграм који ће на апсциси имати удаљеност алфа честица од извора зрачења, а на ординати број јонизацијских парова које стварају алфа честице на разним удаљеностима од извора, добија се Брагова крива. На њеном завршном делу, види се знатан успон, а затим нагли пад.
Тунелисање или тунелски учинак
Велика је потешкоћа настала да се објасни како је могуће да алфа честице, чија кинетичка енергија износи при избацивању из радиоактивних атомских језгара од 4 до 10 , прођу кроз потенцијалну енергетску баријеру, чије највеће вредности код елемената са великим атомским бројем износе око 25 . Према класичној теорији, излази да алфа честице, које се налазе у унутрашњости атомског језгра, не могу продрети кроз баријеру и из њега се ослободити с енергијом, која је мања од енергије потенцијалне баријере. Исто тако, тешко је било објаснити зашто радиоактивни елементи имају тако дуго време полураспада, које на пример за радијум-226 износи 1600 година. То значи да се у тако дугом временском периоду, нуклеони (протони и неутрони) морају држати заједно у атомском језгру, иако понекад спонтано, без спољашњих утицаја, два протона и два неутрона у облику алфа-честице буду избачена из ње.
Тај проблем су теоретски решили 1928. Џорџ Гамов, а независно од њега Роналд Гурни и Едвард Кондон, развивши теорију тунелисања. Према квантној физици постоји вероватноћа да се алфа честица с одређеном енергијом, која је мања од енергије потенцијалне баријере, ослободи атомског језгра, кад дође до његове површине. Ова вероватноћа је већа ако је већа енергија алфа честице и ако је ширина баријере мања од вредности њене енергије. Алфа честица ће на неки начин добити довољну количину енергије од других нуклеарних честица, за свладавање потенцијалне баријере.
За алфа честице способне да доспеју до спољашње површине и да поновно буду убачене у атомско језгро, постоји учесталост. Вредност ове учесталости може се одредити дељењем величине полупречника атомског језгра с процењеном брзином, којом се алфа честице крећу у атомском језгру. Будући да полупречник атомског језгра износи око 10−15 , а брзина алфа честице која се у њему креће износи око 106 , излази да алфа честица долази до спољашње површине приближно 106/10−15 = 1021 пута у секунди, односно да она побегне из језгра након 1021 покушаја. То је заправо суштина тунелског ефекта.
Историја
Џорџ Гамов је 1928. године теоријски објаснио алфа распад преко тунел ефекта[6]. По његовом моделу, алфа честица је заробљена у потенцијалној јами атомског језгра. Према класичној физици, њен излазак из потенцијалне јаме није могућ, међутим, сагласно тада тек откривеним принципима квантне механике постоји малена, али већа од нуле, вероватноћа за тунеловање честице кроз баријеру. На тај начин алфа честица, упркос класичној забрани, успева да напусти језгро.
А Ернест Радерфорд (Ernest Rutheford) је још 1903. доказао да је алфа честица наелектрисана а касније и да се ради о атомском језгру хелијума[7].
Токсичност
Алфа честице ("алфа зрачење") које емитују радиоактивни изотопи представљају један од најопаснијих облика зрачења ако се такви изотопи нађу у људском телу. Као и све тешке наелектрисане честице алфа честице у густој средини губе енергију на врло малим растојањима од извора. Због тога су у биолошким системима изузетно деструктивне. С друге стране, спољашње озрачивање „алфа зрацима“ није штетно јер честице комплетно зауставља микрометарски танак слој изумрлих ћелија коже као и неколико сантиметара ваздуха. Међутим, ако се извор алфа честица унесе у организам, удисањем, гутањем, инјектирањем или продором кроз кожу (шрапнел, ватрено зрно) он постаје озбиљна опасност за угрожени организам.
Прилично распрострањен извор алфа зрачења је радон, радиоактивни гас који се налази у природи и земљишту, стенама а понекад и подземним водама. Када се гасовити радон удахне нешто атома се задржи у унутрашњости плућа и након издисаја. Тако задржана језгра се временом у плућима распадају емитујући алфа честице које оштећују околно ткиво.[8] Шрапнели од артиљеријских зрна направљених од осиромашеног уранијума представљају још један ризик по људско здравље.
Прва жртва озрачивања алфа честицама је Марија Кири чија је леукемија проузрокована дуготрајном излагању алфа емитерима са којима је годинама радила.
У новије време, познато је да је смрт руског шпијуна Александра Литвињенка, узрокована тровањем полонијумом-210 (Po-210) који је јак извор алфа честица.
Види још
Референце
Литература
Спољашње везе
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.






