Kalijev oksid
From Wikipedia, the free encyclopedia
Kalijev oksid je anorganska spojina s formulo K2O. Oksid je bledo rumena trdnina, ki je zaradi velike reaktivnosti slabo obstojna. Vsebnost kalija v nekaterih snoveh, na primer v umetnih gnojilih, se pogosto izraža v ekvivalentih K2O.
 | |
| Imena | |
|---|---|
| IUPAC ime
kalijev oksid | |
| Sistematično ime
kalijev oksidokalij | |
| Druga imena
dikalijev monoksid, potaša | |
| Identifikatorji | |
3D model (JSmol) |
|
| ChemSpider | |
| ECHA InfoCard | 100.032.012 |
| MeSH | Potassium+oxide |
| UNII | |
CompTox Dashboard (EPA) |
|
| |
| |
| Lastnosti | |
| K2O | |
| Molska masa | 94,20 g·mol−1 |
| Videz | bledo rumena trdnina |
| Vonj | brez vonja |
| Gostota | 2,32 g/cm3 (20 °C)[1] 2,13 g/cm3 (24 °C)[2] |
| Tališče | 740 °C (1.360 °F; 1.010 K) |
| reagira,[1] pri čemer nastaja KOH | |
| Topnost | topen v etanolu in dietil etru[2] |
| Struktura | |
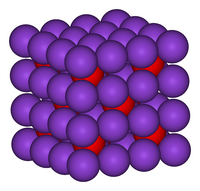
| Kristalna struktura | antifluiritno kubična, pearsonov simbol: cF12[3] |
| Prostorska skupina | Fm3m, No. 225[3] |
Mrežna konstanta |
|
| Koordinacijska geometrija |
tetraedrična (K+) kubična (O2−) |
| Termokemija | |
| Specifična toplota, C | 83,62 J/mol·K[4] |
| Standardna molarna entropija S |
94,03 J/mol·K[4] |
Std tvorbena entalpija (ΔfH⦵298) |
−363,17 kJ/mol[1][4] |
Gibbsova prosta energija (ΔfG˚) |
−322,1 kJ/mol[1] |
| Nevarnosti | |
| Glavne nevarnosti | koroziven, burno reagira z vodo |
| Sorodne snovi | |
| Drugi anioni | kalijev sulfid |
| Drugi kationi | litijev oksid natrijev oksid rubidijev oksid cezijev oksid |
| Sorodno kalijevi oksidi | kalijev peroksid kalijev superoksid |
| Sorodne snovi | kalijev hidroksid |
| Sklici infopolja | |
Sinteza
Kalijev oksid se pripravlja z reakcijo kalija s kisikom. V reakciji nastane najprej kalijev peroksid (K2O2), ki reagira s kalijem in se pretvori v oksid: [5]
- 2K + O2 → K2O2
- K2O2 + 2K → 2K2O
Druga, bolj prikladna, je sinteza s segrevanjem kalijevega nitrata s kovinskim kalijem:
- 2KNO3 + 10K → 6K2O + N2
Kalijev hidroksid se ne da dehidrirati v kalijev oksid, lahko pa reagira z raztaljenim kalijem, pri čemer nastaneta kalijev oksid in vodik:
- 2KOH + 2K → 2K2O + H2
Lastnosti in reakcije
Kalijev oksid kristalizira a antifluoritni kubični strukturi, se pravi da so položaji anionov in kationov ravno obratni kot v kalcijevem fluoridu: kalijevi ioni so koordinirani s štirimi oksidnimi ioni, oksidni ioni pa z osmimi kalijevimi ioni.[6][7]
K2O je bazičen oksid in burno reagira z vodo v kalijev hidroksid. Je higroskopen in živahno reagira tudi z vlago iz zraka.
Uporaba
Kemijska formula K2O (ali enostavneje K) se uporablja v več kontekstih: kot N-P-K v umetnih gnojilih in kot K v industriji cementa in stekla. V teh proizvodih v resnici ni prisoten K2O, ker ni obstojen, ampak kakšna druga kalijeva spojina, na primer kalijev karbonat. Razlog za takšno izražanje vsebnosti je različna vsebnost kalija v njegovih spojinah: v K2O ga je 83 %, v KCl pa samo 52 %. Če umetno gnojilo vsebuje 30 % KCl, je standardna vsebnost kalija, izraženega s kalijevim oksidom, enaka 18,8 %.
Sklici
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
