Dusičnan amónny
chemická zlúčenina From Wikipedia, the free encyclopedia
Remove ads
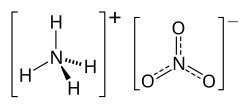
Dusičnan amónny, triviálnym názvom liadok amónny či amóniumnitrát, je chemická zlúčenina (dusičnan amoniaku) s chemickým vzorcom NH4NO3. Pri izbovej teplote a štandardnom tlaku je to biela kryštalická látka. Je bežne používaný v poľnohospodárstve ako hnojivo s vysokým obsahom dusíka, a takisto sa používa aj ako oxidačné činidlo vo výbušninách, vrátane fugasu. Je hlavnou súčasťou veľmi známej výbušniny ANFO.
Remove ads

Kombinácia silnej redukčnej skupiny NH4+ (dusík v oxidačnom stave -III) a silnej oxidačnej skupiny NO3- (dusík v oxidačnom stave +V) v molekule dusičnanu amónneho spôsobuje jeho nestálosť. Pri zahrievaní sa rozkladá podľa rovnice:
- NH4NO3 → N2O + 2 H2O
Tento rozklad pravdepodobne nastáva len v tavenine (nad 169,6 °C - bezvodá soľ). Reakcia je exotermická s entalpiou -36 kJ/mol. Zároveň priebeha aj druhá reakcia:
- NH4NO3 → NH3 + HNO3
Entalpia tejto endotermickej reakcie je 176 kJ/mol. Z toho vyplýva, že tavenina spotrebuje viac tepla, než ho dokáže vytvoriť. Pritom sa vzniknutá kyselina dusičná rozkladá na oxidy dusíka, čo spôsobuje červenohnedé výpary.
Chloridové ióny katalyzujú tento rozklad:
- 5 NH4NO3 → 4 N2 + 2 HNO3 + 9 H2O
Podobné katalytické účinky má i dichróman amónny, čo sa využíva v pyrotechnických zložiach.
Detonácia dusičnanu amónneho je exotermická reakcia (na rozdiel od endotermického rozkladu na oxid dusný a vodu):
- NH4NO3 → N2 + 1/2 O2 + 2 H2O
Remove ads
Použitie
Zahrievanie alebo akékoľvek zdroje vzplanutia môžu spôsobiť prudké horenie alebo explóziu. Dusičnan amónny reaguje s horľavými materiálmi, pričom oxiduje materiál (a sám sa redukuje), pretože je silný oxidant. Je používaný predovšetkým ako hnojivo a vo výbušninách. Dusičnany amoniaku sú tiež používané na úpravu rýchlosti detonácie iných výbušnín.
Výroba
Dusičnan amónny sa pripravuje reakciou kyseliny dusičnej a čpavku.[2]
- HNO3 + NH3 → NH4NO3.
Dusičnan amónny sa amatérsky vyrába reakciou:
- (NH4)2SO4 + 2 NaNO3 → Na2SO4 + 2 NH4NO3
- Ca(NO3)2 + (NH4)2SO4 → 2 NH4NO3 + CaSO4
Tato reakcia je silne exotermická. Pripraviť sa dá tiež reakciou AgNO3(aq) s NH4Cl(aq), pričom vzniká ako nerozpustná soľ AgCl, ktorá sa dá odfiltrovať, takže výťažok je potom pomerne vysoký.
Remove ads
Kryštalizačné fázy
Transformácia kryštalického stavu vzhľadom k meniacim sa podmienkam (teplota, tlak) má vplyv na fyzikálne vlastnosti dusičnanu amónneho. Boli identifikované nasledujúce kryštalické stavy:
Referencie
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads