Boyle-Mariotteov zakon
From Wikipedia, the free encyclopedia
Bojl-Mariotov zakon (negde poznat kao i Bojlov zakon) je jedan od zakona gasova. Ime je dobio po irskom prirodnjaku Robertu Bojlu[1] i francuskom fizičaru Edmu Mariotu. Ovaj zakon je primenljiv je na gasovita tela koja se ponašaju poput idealnih gasova.[2][3] Zakon glasi:
Na konstantnoj temperaturi i nepromenjenoj količini gasa, proizvod pritiska i zapremine je konstantan.[2]
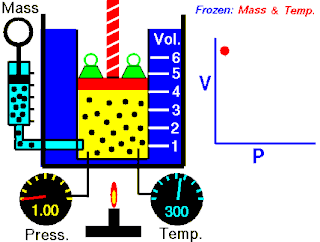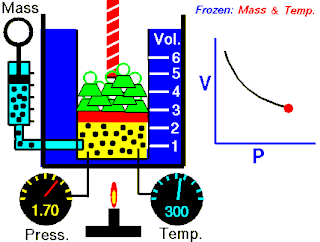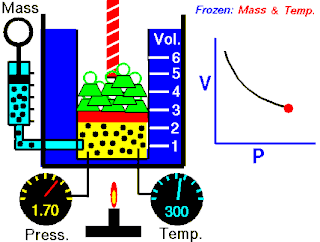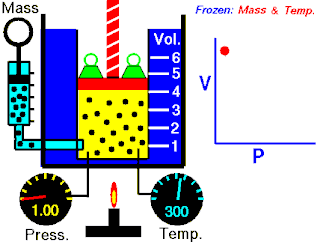
To znači za koliko puta povećamo pritisak toliko puta ćemo smanjiti zapreminu. Procesi koji se dešavaju na konstantnim tempreraturama su izotermski procesi.
Formula
Ovaj zakon je izveden iz osnovne jednačine molekulsko kinetičke teorije gasova.
gde je:
- - pritisak,
- - koncentracija gasa,
- - srednja kinetička energija gasa.
Celu jednačinu pomnožimo sa i dobijamo, pošto je
.
Međutim glavni uslovi za ovaj zakon je da su: , . Znači da je proizvod pritiska i zapremine takođe jednak konstanti:
, ili
Bojl-Mariotov zakon ima veliku primenu (recimo kod ronjenja).
Izvori
Literatura
Wikiwand - on
Seamless Wikipedia browsing. On steroids.











