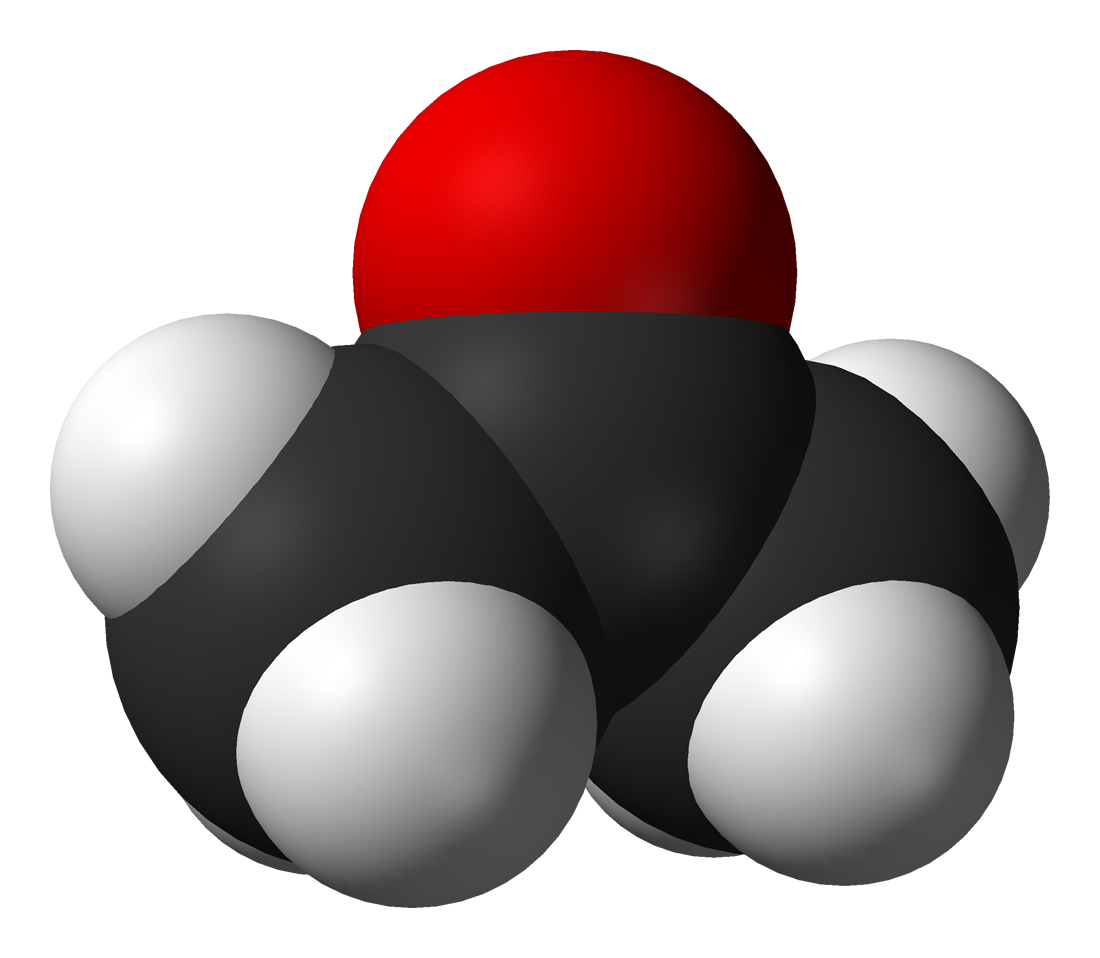
Aceton
From Wikipedia, the free encyclopedia
Aceton je organsko jedinjenje sa formulom (CH3)2CO. Aceton je najjednostavnije jedinjenje u klasi ketona.[6]
| Aceton[1] | |
|---|---|
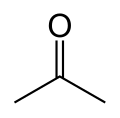 |
 |
 |
 |
Propanone | |
| Naziv po klasifikaciji | Propan-2-on |
| Drugi nazivi | Dimetilformaldehid Dimetil keton |
| Identifikacija | |
| Abrevijacija | DMK |
| CAS registarski broj | 67-64-1 , 7217-25-6 (1,3-13C2) |
| PubChem[2][3] | 180 , 451253 (1-11C) , 451245 (2-11C) , 11007810 (2-13C), 11126172 (2-14C) , 13001281 (1,3-13C2) |
| ChemSpider[4] | 175 , 9301292 (2-14C) |
| UNII | 1364PS73AF |
| EINECS broj | |
| UN broj | 1090 |
| KEGG[5] | |
| MeSH | |
| ChEBI | 15347 |
| RTECS registarski broj toksičnosti | AL31500000 |
| Bajlštajn | 635680 |
| Gmelin Referenca | 1466 |
| 3DMet | B00058 |
| Jmol-3D slike | Slika 1 Slika 2 |
| Svojstva | |
| Molekulska formula | C3H6O |
| Molarna masa | 58.08 g mol−1 |
| Agregatno stanje | Bezbojna tečnost (bele je boje u čvrstom stanju) |
| Gustina | 0,7925 g/cm3 |
| Tačka topljenja |
−94.9 °C, 178 K, -139 °F |
| Tačka ključanja |
56.53 °C, 330 K, 134 °F |
| Rastvorljivost u vodi | rastvoran je |
| pKa | 24,2 |
| Indeks prelamanja (nD) | 1,35900 (20 °C) |
| Viskoznost | 0,3075 cP |
| Struktura | |
| Oblik molekula (orbitale i hibridizacija) | trigonalna planarna kod C=O |
| Dipolni moment | 2,91 D |
| Opasnost | |
| EU-klasifikacija | |
| NFPA 704 | |
| R-oznake | R11, R36, R66, R67 |
| S-oznake | S2, S9, S16, S26 |
| Tačka paljenja | −17 °C |
| Tačka spontanog paljenja | 465 °C |
| Eksplozivni limiti | 4.0–57.0 |
| LD50 | >2000 mg/kg, oralno (pacov) |
| Srodna jedinjenja | |
| Srodna rastvarači | voda Etanol Izopropanol Toluol |
|
(šta je ovo?)
(verifikuj)
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |
| Infobox references | |
Osobine
Aceton je bistra bezbojna tečnost prijatnog mirisa koja dosta isparava već na sobnoj temperaturi. Rastvara se u vodi ključa na 56 °C. Aceton je veoma zapaljiva tečnost sa temperaturom paljenja od 19 °C. Ovo jedinjenje je samozapaljivo na 540 °C.
Aceton se prirodno proizvodi i odstranjuje iz ljudskog tela kao rezultat normalnih metaboličkih procesa. Testovi reproduktivne toksičnosti su pokazali da ima nizak potencijal da prouzrokuje reproduktivne probleme.
Upotreba
Aceton služi kao važan rastvarač. On je uobičajeni rastvarač za čišćenje u laboratorijama. Više od 3 miliona tona se proizvede godišnje, najvećim delom kao prekurzor za polimer.[7] Poznata kućna upotreba acetona je kao aktivni sastojak odstranjivača laka za nokte i kao razređivač boja. On se često koristi u organskim hemijskim reakcijama.
Industrijska proizvodnja
Aceton se proizvodi direktno ili indirektno iz propilena. Najčešće se koristi kumenski proces, u kome se benzen se alkiluje sa propenom i rezultirajući kumen (izopropilbenzen) se oksiduje i nastaju fenol i aceton:
- C6H5CH(CH3)2 + O2 → C6H5OH + (CH3)2CO
Ova konverzija podrazumeva prisustvo intermedijara kumen hidroperoksida, C6H5C(OOH)(CH3)2.
Aceton se takođe proizvodi direktnom oksidacijom propena sa Pd(II)/Cu(II) katalizatorom.
Reference
Wikiwand - on
Seamless Wikipedia browsing. On steroids.