علم ڪيميا یا ڪيمسٽري (Chemistry)، مادي جو علم جنهن ۾ مادي جي اندرين جوڙجڪ، بناوت ۽ ان ۾ ايندڙ تبديلين جي علم کي چئبو آهي. ڪيمسٽري مادي جي خاصيتن ۽ رويي جو سائنسي مطالعو آهي. اها قدرتي سائنس جي اندر هڪ فزيڪل سائنس آهي جيڪا ڪيميائي عنصرن جو مطالعو ڪري ٿي جيڪي مادو ٺاهين ٿا ۽ ائٽم، ماليڪيولز ۽ آئنز مان ٺهيل مرکبات: انهن جي بناوت، ساخت، خاصيتن، رويي ۽ انهن ۾ تبديليون جيڪي ٻين مادي سان رد عمل دوران ٿين ٿيون. ڪيمسٽري پڻ ڪيميائي مرڪب ۾ ڪيميائي بانڊ جي فطرت جو مطالعو ڪري ٿي. علم ڪيميا جي لحاظ کان مادي کي ٽن گروهن ۾ ورهايو ويندو آهي. عنصر، مرڪب ۽ آمیزو.

ان جي موضوع جي دائري ۾، ڪيمسٽري فزڪس ۽ حياتيات جي وچ ۾ هڪ وچولي پوزيشن تي قبضو ڪري ٿي. ان کي ڪڏهن ڪڏهن مرڪزي سائنس به سڏيو ويندو آهي ڇاڪاڻ ته اها بنيادي ۽ لاڳو ٿيل سائنسي مضمونن کي بنيادي سطح تي سمجهڻ لاءِ بنياد فراهم ڪري ٿي. مثال طور، ڪيمسٽري ٻوٽن جي واڌ ويجهه جي پهلوئن کي بيان ڪري ٿي (بوٽني)، اگنيئس پٿرن جي ٺهڻ (جيولوجي)، ماحوليات ۾ اوزون ڪيئن ٺهندو آهي ۽ ماحولياتي آلودگي ڪيئن خراب ٿيندي آهي (ماحوليات)، چنڊ تي مٽي جي خاصيتون (ڪاسمو ڪيمسٽري)، دوائن جو ڪم (فارماڪولوجي) ۽ جرم جي منظر ۾ ڊي اين اي ثبوت ڪيئن گڏ ڪجي (فارنسڪ).
ڪيميا قديم زماني کان وٺي مختلف نالن سان موجود آهي. اهو هاڻي ترقي ڪري چڪو آهي ۽ ڪيمسٽري اسپيشلائيزيشن جي مختلف شعبن يا ذيلي تقسيم تي مشتمل آهي جيڪي تعداد ۾ وڌندا رهندا آهن ۽ مطالعي جي وڌيڪ بين الاقوامي شعبن کي ٺاهڻ لاء هڪ ٻئي سان ڳنڍيل آهن. ڪيمسٽري جي مختلف شعبن جون ايپليڪيشنون اڪثر ڪري ڪيميائي صنعت ۾ اقتصادي مقصدن لاءِ استعمال ٿينديون آهن.
نالو
لفظ "ڪيميا" لفظ "الڪيمي" جي ريناسنس جي دور ۾ هڪ ترميم مان آيو آهي، جيڪو عملن جي هڪ اڳوڻي سيٽ ڏانهن اشارو ڪيو ويو آهي جنهن ۾ ڪيميا، فلڪيات، فلسفو، علم نجوم، تصوف ۽ طب جا عنصر شامل هئا. الڪيمي اڪثر ڪري سيسي (Lead) يا ٻين بنيادي ڌاتن کي سون ۾ تبديل ڪرڻ جي جستجو سان جڙيل آهي، جيتوڻيڪ الڪيميا جي ماهرن کي پڻ جديد ڪيميا جي ڪيترن ئي سوالن ۾ دلچسپي هئي. جديد لفظ الڪيمي (Alchemy) بدلي ۾ عربي لفظ "الڪيمياء" مان نڪتل آهي. ٿي سگهي ٿو ته اهو مصري هجي ڇاڪاڻ ته الڪيميا قديم يوناني لفظ، "χημία" (کيميا) مان نڪتل آهي، جيڪو بدلي ۾ لفظ "ڪيميت" (Kemet) مان نڪتل آهي، جيڪو مصري ٻوليءَ ۾ مصر جو قديم نالو آهي. متبادل طور تي، الڪيميا χημεία (کيميا، گڏ ٺهڻ) مان نڪتل ٿي سگھي ٿو.
تعارف
علم ڪيميا مادي جي ثن حالتن کي يعني نهرو (Solid)، مائع (Liquid) ۽ گئس (Gass) تي بحث ڪري ٿي. جيئن ته پاڻي ڪهڙي عنصرن تي ٺهيل آهي. اها مادي ۾ رونما ٿيندڙ خاصيتي تبديلن کي رونما ڪري سندن مطلق ڄاڻ ڏي ٿي. سائنس جي اها شاخ جنهن ۾ مادي، انجي بناوٽ، انجون خصوصيتون ۽ انجي تبديلين بابت مطالعا ۽ مشاهدا ڪيا ويندا آهن.
ڪيمسٽري يا علم ڪيميا شين جي سائنس سان تعلق رکندڙ علم آھي. اھو ٻڌائيندو آھي تہ شيون جڏهن پاڻ ۾ ملنديون آهن تہ ان سان ڪيئن تبديليون اينديون آهن. ھيء سائنس اوتري پراڻي آهي جيتري انساني تھذيب آھي. ھن علم جون ڪيتريون ئي شاخون آهن. جن مان نامياتي ڪيميا ۽ غير نامياتي ڪيميا اھم آهن. ان جو ھڪ قسم صنعتي ڪيميا آهي جنھن سان تمام ڪارآمد شيون تيار ڪيون ويون آهن پر انھن جي تياري جي دوران خارج ٿيڻ وارن مرڪبن ماحول ۾ گدلاڻ پيدا ڪري ڇڏي آهي. ڪنھن به شئي جي ڪيمسٽري جو اڀياس ٽن اصولن تحت ڪيو ويندو آهي.
- پھرين مرحلي ۾ ان جي بناوٽ
- ٻئي مرحلي ۾ ان جون خصوصيتون
- ٽئين مرحلي ۾ ان شئي جون ڪيميائي تبديليون
علم ڪيميا ۾ سائنسي طريقي جي تشريح مشاھدن، مفروضن، نظرين ۽ سائنسي قانونن جي ذريعي ڪئي ويندي آهي.
تاريخ
قديم دور
علم ڪيميا جي تاريخ ان وقت شروع ٿيندي آھي جڏھن انسان پنھنجي اردگرد جو اڀياس شروع ڪيو تہ انھن جي سامھون موجود شيون ڪھڙي طرح انھن جي ضرورتن کي پورو ڪرڻ لاءِ ڪار آمد ٿي سگھن ٿيون. ان وقت انھن شين ۾ پٿر، ڪاٺيون ۽ لوھ سرفهرست ھيا. پٿرن سان گڏوگڏ انھن پھاڙن جو مشاھدو ڪيو ۽ انھن مان ڌاتو حاصل ڪيا. پٿرن کي پاڻ ۾ گسائي باھ ٻارڻ جو طريقو سکڻ کان پوءِ اھو سمجھڻ شروع ڪيو تہ ڪھڙيون شيون باھ ۾ سڙي وڃن ٿيون ۽ ڪھڙين شين تي باھ اثر نہ ٿي ڪري. پوء اتفاق سان واري گرم ڪندي شيشو ٺاھڻ جو فن سکي ويا. اھا سموري ترقي سطحي ۽ مختلف اندازن تي مشتمل ھئي.
يوناني دور
ھي دور لڳ ڀڳ 600 ق.م کان شروع ٿئي ٿو. ھن دور ۾ يوناني سائنسدان ارسطو تمام گھڻو مشھور آھي. ان سان گڏ سقراط ۽ افلاطون به جن سائنسي مظھرن کي فلسفيانہ انداز ۾ سوچي اڀياس ڪرڻ شروع ڪيو. ارسطو ۽ ٻين يوناني فلسفين مطابق ھر شئي چئن عنصرن مان ٺھيل آھي: مٽي، ھوا، باھ ۽ پاڻي. انھن مطابق باھ گرم ۽ خشڪ ھئي، مٽي خشڪ ۽ ٿڌي، ھوا ۽ پاڻي ٻئي ٿڌا، گرم ۽ آلاڻ وارا ھوندا آھن. رومن علم ڪيميا ۾ وڌيڪ اضافا ڪيا. انھن ڌاتن مان شيون ٺاھڻ جي فن کي بھتر بڻايو ۽ مٽيءَ جي ٿانون تي انيمل (enemal) ڪرڻ جو طريقو ايجاد ڪيو.
اسلامي دور
ھي دور 600 عيسويءَ کان 1600 تائين جاري رھيو. ھن دور ۾ ڪيتريون ئي شيون ايجاد ۽ دريافت ڪيون ويون. ان دور ۾ تجربن ۾ استعمال ٿيڻ واريون شيون قيف، بيڪر، ترازو ايجاد ڪيا ويا. جابر بن حيان شوري جو تيزاب يا نائٽرڪ ايسڊ، لوڻ جو تيزاب يا ھائڊروڪلورڪ ايسڊ ٺاھڻ جا طريقا دريافت ڪيا. ھن ڪپڙن کي رڱڻ ۽ ڌاتوڪاري جا طريقا به دريافت ڪيا. الرازي ھڪ طبيب يا فزيشن، ڪيمسٽ، فلسفي ۽ ماھر جراح يا سرجن ھيو. ھن سڀ کان پھريون آفيم جو ماڻھو کي بيھوش ڪرڻ وارو استعمال ڪيو. ھن ڪيميائي شين جي جاندار ۽ بي جان واري حساب سان درجہ بندي ڪئي. بو علي سينا دواسازي ۽ دوائن جي ڪيميا (Pharmacy)، فلسفي، رياضي ۽ فلڪيات جي علم تي ڪم ڪيو. البيروني ڪيميائي شين جي گھاٽائي يا ڪثافت ۽ اضافي گھاٽائي معلوم ڪئي.
جديد ڪيميائي دور
ھن دور جو آغاز 1700 کان ٿيو. رابرٽ بوائل جو شمار جديد ڪيمسٽري جي بانين مان ٿئي ٿو. جان ڊالٽن ايٽمي نظريو پيش ڪيو جنھن سان علم ڪيميا ۾ تمام گھڻو واڌارو آيو. مينڊليف عنصرن جي مطالعي کي عنصرن جي نئين ترتيب ذريعي اڳتي وڌايو ۽ عنصرن جي درجي بندي سان انھن جي خصوصيتن ۽ نون عنصرن جي دريافت ۾ آساني پيدا ٿي. نيل بوھر ۽ ردرفورڊ ايٽم جي بناوٽ ۽ تابڪاري جي باري ۾ مفيد ڄاڻ فراهم ڪئي اھڙي طرح ايٽمي ڪيمسٽري جو آغاز ٿيو.
جديد اصول

ڪيميا ۾ اڀياس، تعمل ۽ تبديليون عام طور تي ايٽم جي وچ ۾ رابطي جو نتيجو آهن، جيڪي ڪيميائي بانڊن جي ٻيهر ترتيب ڏيڻ جو سبب بڻجن ٿا ۽ ايٽم کي گڏ ڪن ٿا. اهڙي رويي کي ڪيمسٽري ليبارٽري ۾ اڀياس ڪيو ويندو آهي.
ڪيمسٽري ليبارٽري اسٽيريوٽائپ طور تي ليبارٽري شيشي جي سامان جي مختلف شڪلن کي استعمال ڪندي آهي. تنهن هوندي به شيشي جو سامان ڪيمسٽري ۾ مرڪزي نه آهي ۽ تجرباتي (انهي سان گڏوگڏ لاڳو ٿيل/صنعتي) ڪيميا جو وڏو معاملو ان کان سواء ڪيو ويندو آهي.
هڪ ڪيميائي عمل ڪجهه مادي جي هڪ يا وڌيڪ مختلف مادي ۾ تبديلي آهي.[1] اهڙي ڪيميائي تبديليءَ جو بنياد ائٽم جي وچ ۾ ڪيميائي بانڊن ۾ اليڪٽرانن جي ٻيهر ترتيب آهي. اهو علامتي طور تي هڪ ڪيميائي مساوات جي ذريعي ظاهر ڪري سگهجي ٿو، جنهن ۾ عام طور تي مضمونن (Subject) جي طور تي ايٽم شامل آهن. ڪيميائي تبديليءَ جي مساوات ۾ کاٻي ۽ ساڄي پاسي جي ائٽمن جو تعداد برابر هجي. جڏهن ٻنهي پاسن تي ائٽم جو تعداد غير برابر هجي ته ان تبديلي کي ائٽمي عمل يا تابڪاري زوال چئبو آهي. ڪيميائي عمل ۾ هڪ قسم جي مادي ۽ ان سان گڏ ٿيندڙ توانائيءَ جي تبديلين کي ڪجهه بنيادي قاعدن سان محدود ڪيو ويندو آهي، جنهن کي ڪيميائي قانونن جي نالي سان سڃاتو وڃي ٿو.
تقريبن سڀني ڪيميائي مطالعي ۾ توانائي ۽ انٽروپي (Entropy) جا خيال هميشه اهم آهن. ڪيميائي مادا انهن جي جوڙجڪ، مرحلي ۽ گڏوگڏ انهن جي ڪيميائي مجموعن جي لحاظ کان درجه بندي ڪيا ويا آهن. انهن کي ڪيميائي تجزيي جي اوزار، مثال طور، اسپيڪٽرواسڪوپي ۽ ڪروميٽوگرافي، استعمال ڪندي تجزيو ڪري سگهجي ٿو. ڪيميائي تحقيق ۾ مصروف سائنسدانن کي ڪيميادان طور سڃاتو وڃي ٿو.[2] اڪثر ڪيميا دان هڪ يا وڌيڪ ذيلي مضمونن ۾ ماهر هوندا آهن. ڪيميا جي مطالعي لاءِ ڪيترائي تصور ضروري آھن. انهن مان ڪجهه هي آهن:[3]
مادو
- اصل مضمون جي لاءِ ڏسو مادو
ڪيمسٽري ۾، مادو ڪنهن به شيءِ جي طور تي بيان ڪيو ويو آهي جنهن ۾ ڪميت (Mass) ۽ حجم (Volume) هجي (اهو جاء وٺندو آهي) ۽ ذرات مان ٺهيل آهي. ذرڙا جيڪي مادو ٺاهيندا آهن انهن ۾ پڻ ماس هوندو آهي. سڀني ذرڙن ۾ ماس نه هوندو آهي، جهڙوڪ فوٽان ۾ ماس نه هوندو آهي. مادو خالص ڪيميائي مادو يا مادي جو مرکب ٿي سگهي ٿو.[4]
ائٽم
- اصل مضمون جي لاءِ ڏسو ائٽم

ائٽم ڪيميا جو بنيادي يونٽ آهي. اهو هڪ ٿلهي ڪور تي مشتمل آهي جنهن کي ايٽمي نيوڪليس سڏيو ويندو آهي جنهن جي چوڌاري هڪ خلا آهي جيڪو اليڪٽران ڪلائوڊ جي قبضي ۾ آهي. نيوڪلئس مثبت طور تي چارج ٿيل پروٽان ۽ اڻ چارج ٿيل نيوٽرانن (جنهن کي گڏ ڪري نيوڪلون سڏيو ويندو آهي) جو ٺهيل هوندو آهي، جڏهن ته اليڪٽران ڪلائوڊ منفي طور تي چارج ٿيل اليڪٽرانن تي مشتمل هوندو آهي جيڪي نيوڪلئس جي چوڌاري گردش ڪندا آهن. هڪ غير جانبدار ايٽم ۾، منفي طور تي چارج ٿيل اليڪٽران پروٽان جي مثبت چارج کي توازن ڪن ٿا. نيوڪليس گھڻ آهي؛ نيوڪلون جو ماس هڪ اليڪٽران جي لڳ ڀڳ 1,836 ڀيرا آهي، پر ان جي باوجود هڪ ائٽم جو ريڊيس ان جي نيوڪليس کان 10,000 ڀيرا وڌيڪ آهي.[5][6]
ائٽم پڻ ننڍڙو ادارو آهي جنهن کي عنصر جي ڪيميائي ملڪيتن کي برقرار رکڻ لاءِ تصور ڪري سگهجي ٿو، جهڙوڪ اليڪٽرونگيٽيٽي، آئنائيزيشن جي امڪاني، ترجيحي آڪسائيڊريشن اسٽيٽ(ز)، ڪوآرڊينيشن نمبر، ۽ بانڊن جا ترجيحي قسم ٺاهڻ لاءِ (مثال طور، ڌاتو، آئنڪ) , covalent).
عنصر

- اصل مضمون جي لاءِ ڏسو ڪيميائي عنصر
ڪيميائي عنصر هڪ خالص مادو آهي جيڪو هڪ قسم جي ايٽم مان ٺهيل هوندو آهي، جنهن جي خاصيت ان جي ايٽم جي نيوڪلئي ۾ پروٽانن جي مخصوص تعداد جي ڪري هوندي آهي، جنهن کي ايٽمي نمبر سڏيو ويندو آهي ۽ علامت Z سان ظاھر ڪيو ويندو آهي. ماس نمبر جو مجموعو آهي. نيوڪليس ۾ پروٽان ۽ نيوٽران جو تعداد. جيتوڻيڪ هڪ عنصر سان تعلق رکندڙ سڀني ايٽمن جي نيوڪلي جو هڪ ئي ايٽمي نمبر هوندو، پر ضروري ناهي ته انهن جو ماس نمبر ساڳيو هجي. ڪنهن عنصر جا ايٽم جن جا ماس انگ مختلف هوندا آهن انهن کي آئسوٽوپس چيو ويندو آهي. مثال طور، سڀئي ايٽم جن جي مرڪز ۾ 6 پروٽون آهن، ڪيميائي عنصر ڪاربن جا ايٽم آهن، پر ڪاربان جا ايٽم شايد 12 يا 13 جو ماس نمبر هجن.[6]
ڪيميائي عناصر جي معياري پيشڪش دورانياتي جدول ۾ آهي، جيڪو عناصر کي ايٽمي نمبر جي ترتيب ڏئي ٿو. دوراني جدول گروپن، ڪالمن، ۽ دورن، يا قطارن ۾ ترتيب ڏنل آھي. دورانياتي جدول دوراني رجحانن کي سڃاڻڻ ۾ ڪارآمد آهي.[7]
مرڪب
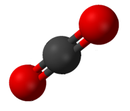
- اصل مضمون جي لاءِ ڏسو ڪيميائي مرڪب
مرڪب هڪ خالص ڪيميائي مادو آهي جيڪو هڪ کان وڌيڪ عنصرن تي مشتمل هوندو آهي. مرڪب جون خاصيتون ان جي عناصرن سان ٿوري مشابهت رکن ٿيون.[8] مرڪبن جا معياري نالا انٽرنيشنل يونين آف پيور اينڊ اپلائيڊ ڪيمسٽري (IUPAC) طرفان مقرر ڪيو ويو آهي. نامياتي مرڪبن جا نالا نامياتي نومنڪليچر نظام جي مطابق رکيا ويا آهن.[9] غير نامياتي مرڪبن جا نالا غير نامياتي نومنڪليچر نظام جي مطابق ٺاهيا ويا آهن. جڏهن هڪ مرڪب هڪ کان وڌيڪ جزن تي مشتمل هوندو آهي ته پوءِ انهن کي ٻن جزن، اليڪٽرو پوزيٽيو ۽ اليڪٽرونيگيٽيو، ۾ ورهايو ويندو آهي. ان کان علاوه ڪيميائي ابسترڪت سروس ڪيميائي مواد کي ترتيب ڏيڻ لاء هڪ طريقو ٺاهيو آهي. هن اسڪيم ۾ هر ڪيميائي مادو هڪ نمبر ذريعي سڃاڻي سگهجي ٿو جيڪو ان جي CAS رجسٽري نمبر طور سڃاتو وڃي ٿو.[10]
ماليڪيول
- اصل مضمون جي لاءِ ڏسو ماليڪيول

هڪ ماليڪيول هڪ خالص ڪيميائي مادي جو سڀ کان ننڍڙو ناقابل تقسيم حصو آهي، جنهن ۾ ڪيميائي خاصيتن جو هڪ منفرد سيٽ هوندو آهي، جنهن ۾، ٻين مادن سان ڪيميائي عمل جي هڪ خاص سيٽ مان گذرڻ جي صلاحيت هوندي آهي. بهرحال، هي وصف صرف انهن شين لاءِ سٺو ڪم ڪري ٿو جيڪي ماليڪيولن مان ٺهيل آهن، جيڪي ڪيترن ئي مادن لاءِ درست نه آهن. ماليڪيول عام طور تي ڪوويلنٽ بانڊن سان جڙيل ايٽمن جو هڪ سيٽ هوندا آهن، جيئن ته ساخت برقي طور تي غير جانبدار هجي ۽ سڀئي ويلنس اليڪٽران ٻين اليڪٽرانن سان يا ته بانڊن ۾ يا اڪيلي جوڙڻ ۾ جڙيل هوندا آهن.
اهڙيء طرح، ماليڪيول، آئنز جي برعڪس، برقي طور تي غير جانبدار اڪائين، جي طور موجود آهن. جڏهن هي قاعدو، ماليڪيول کي چارج ڏيڻ ذريعي ٽوڙيو ويندو آهي، نتيجي ۾، هڪ ماليڪيول آئن يا پولي ائٽومڪ آئن جو نالو ڏنو ويندو آهي. بهرحال، ماليڪيولر تصور جي الڳ ۽ الڳ نوعيت کي عام طور تي گهربل آهي ته ماليڪيولر آئنز، ماس اسپيڪٽروميٽر ۾ ويڪيوم ۾ رخ ٿيل بيم صرف چڱيءَ طرح جدا ٿيل شڪل ۾ موجود هجن. چارج ٿيل پولي ائٽومڪ مجموعا جيڪي سولڊن ۾ رهندا آهن (مثال طور، عام سلفيٽ يا نائٽريٽ آئن) عام طور تي ڪيميا ۾ "ماليڪيول" نه سمجهيا ويندا آهن. ڪجهه ماليڪيولن ۾ هڪ يا وڌيڪ اڻ جڙيل اليڪٽران هوندا آهن، جيڪا ريڊيڪل ٺاهيندا آهن. اڪثر ريڊيڪل نسبتاً ردعمل وارا هوندا آهن، پر ڪجهه، جهڙوڪ نائٽرڪ آڪسائيڊ مستحڪم ٿي سگهن ٿا.
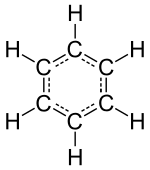
"پرامن" يا نوبل گيس عناصر (هيليم، نيون، آرگن، ڪرپٽان، زينون ۽ ريڊون) انهن جي ننڍي کان ننڍي ڌار ڌار اڪائي جي طور تي، اڪيلي ايٽم تي مشتمل آهن، پر ٻيا الڳ ٿيل ڪيميائي عناصر يا ته ماليڪيول يا ايٽم جي نيٽ ورڪن تي مشتمل آهن، ڪنهن طريقي سان هڪ ٻئي سان ڳنڍيل آهن. سڃاڻي سگهڻ وارا ماليڪيول واقف مادا جهڙوڪ پاڻي، هوا، ۽ ڪيترائي نامياتي مرکبات جهڙوڪ شراب، کنڊ، گيسولين ۽ مختلف دوائون ٺهندا آهن. بهرحال، سڀئي شيون يا ڪيميائي مرڪب ڌار ڌار ماليڪيولن تي مشتمل نه هوندا آهن ۽ حقيقت ۾ اڪثر نهرا مادا جيڪي ٺهڪندڙ ڪرسٽ، مينٽل ۽ ڌرتيء جي بنيادن کي ٺاهيندا آهن، اها بغير ماليڪيول جا ڪيميائي مرڪب آهن. اهي ٻئي قسم جا مادا، جهڙوڪ آئني مرڪب ۽ نيٽ ورڪ سولڊ، اهڙي طرح منظم ڪيا ويا آهن ته جيئن سڃاڻي سگهندڙ ماليڪيولن جو وجود ئي نه هجي. ان جي بدران، اهي مادو فارمولا اڪائين يا اڪائي سيلز جي لحاظ کان مادي جي اندر ننڍڙي ورجائيندڙ ساخت جي طور تي بحث ڪيا ويا آهن. اهڙين شين جا مثال؛ معدني لوڻ (جهڙوڪ عام لوڻ)، سولڊ جهڙوڪ ڪاربن ۽ هيرا، ڌاتو ۽ سڃاتل سليڪا ۽ سليڪٽ معدنيات جهڙوڪ کوارٽز ۽ گرينائيٽ آهن. هڪ ماليڪيول جي مکيه خاصيتن مان هڪ، ان جي جاميٽري آهي، جن کي اڪثر ڪري ان جي ساخت کي سڏيو ويندو آهي. جڏهن ته ڊائٽامڪ (diatomic)، ٽرائي ائٽومڪ (triatomic) يا ٽيٽرا ائٽومڪ (tetra-atomic) ماليڪيولن جي جوڙجڪ معمولي ٿي سگهي ٿي، پولي ائٽومڪ ماليڪيولن (لڪيري، زاويائي، مخروطي وغيره) جي جوڙجڪ، جيڪي ڇهن کان وڌيڪ ايٽمن تي مشتمل آهن (ڪيترن ئي عنصرن جي) ان جي ڪيميائي نوعيت لاءِ اهم ٿي سگهي ٿي.
شيون ۽ آميزا
ڏسو: مڪسچر
ڪيميائي مادو هڪ قسم جو مادو آهي جنهن ۾ هڪ خاص ساخت ۽ خاصيتن جو سيٽ آهي. [11] مادي جي مجموعن کي آميزو يا مڪسچر (Mixture) چئبو آهي. مڪسچر جي مثالن ۾ هوا ۽ مصر (Alloy) شامل آهن.[12]
مول ۽ شي جي مقدار
- اصل مضمون جي لاءِ ڏسو مول
مول ماپ جي هڪ اڪائي آهي جيڪا مادي جي مقدار کي ظاهر ڪري ٿي (جنهن کي ڪيميائي مقدار پڻ سڏيو ويندو آهي). ھڪڙي مول جي وضاحت 6.02214076×1023 ذرڙا (ايٽم، ماليڪيول، آئنز، يا اليڪٽران) سان ڪئي وئي آھي، جتي ذرڙن جو تعداد في مول کي ايووگاڊرو مستقل Avogadro) constant) طور سڃاتو وڃي ٿو. [13] مولر ڪنسنٽريشن هڪ خاص مادي جي مقدار حل جي في اڪائي مقدار ۾ آهي ۽ عام طور تي مول في ڪعبي ڊيسي ميٽر (mol/dm3) ۾ ڄاڻايل آهي.[14]
مرحلا

- اصل مضمون جي لاءِ ڏسو مرحلا (مادو)
مخصوص ڪيميائي خاصيتن کان علاوه جيڪي مختلف ڪيميائي درجه بندي ۾ فرق ڪن ٿيون، ڪيميائي شيون ڪيترن ئي مرحلن ۾ موجود ٿي سگهن ٿيون. سڀ کان وڌيڪ حصي لاء، ڪيميائي درجه بندي انهن بلڪ مرحلن جي درجه بندي کان آزاد آهي؛ تنهن هوندي به، ڪجهه وڌيڪ غير معمولي مرحلا ڪجهه ڪيميائي خاصيتن سان مطابقت نه رکندا آهن. هڪ مرحلو (Phase) هڪ ڪيميائي نظام جي خاصيتن جو هڪ سيٽ آهي جنهن ۾، مختلف حالتن جي حد تائين، جهڙوڪ دٻاء يا درجه حرارت، هڪجهڙيون بلڪ ساختماني خاصيتون آهن.
طبيعي خاصيتون، جهڙوڪ کثافت ۽ اضطراب واري انڊيڪس (Refractive Index) مرحلن جي خاصيتن جي قيمتن ۾ گر ٿي ويندا آهن. مادي جو مرحلو "مرحلو منتقلي" جي ذريعي بيان ڪيو ويو آهي، جيڪو جڏهن توانائي کي، بلڪ حالتن کي تبديل ڪرڻ جي بدران، نظام جي جوڙجڪ کي ٻيهر ترتيب ڏيڻ لاء نظام ۾ داخل ڪيو ويندو آهي يا ٻاهر ڪڍيو وڃي ٿو، آهي.
ڪڏهن ڪڏهن مرحلن جي وچ ۾ تفاوت هڪ الڳ حدن جي بدران مسلسل ٿي سگهي ٿو، ان صورت ۾ مادو هڪ انتهائي اهم حالت ۾ سمجهيو ويندو آهي. جڏهن ٽي حالتون شرطن (Conditions) جي بنياد تي ملن ٿيون، ان کي ٽنهي نقطي طور سڃاتو وڃي ٿو ۽ جيئن ته هي غير متضاد آهي، اها شرطن جي هڪ سيٽ کي بيان ڪرڻ جو هڪ آسان طريقو آهي.
مرحلن جا سڀ کان وڌيڪ واقف مثال نهرا (Solids)، مائع ۽ گيس آهن. ڪيتريون ئي شيون ڪيترن ئي مضبوط مرحلن کي ڏيکارڻ ٿيون. مثال طور، نهري لوھه جا ٽي مرحلا (الفا، گاما ۽ ڊيلٽا) آھن جيڪي گرميء پد ۽ دٻاء جي بنياد تي مختلف آھن. مضبوط مرحلن جي وچ ۾ هڪ بنيادي فرق ڪرسٽل جي ائٽمن جي جوڙجڪ يا ترتيب آهي. ٻيو مرحلو عام طور تي ڪيميا جي مطالعي ۾ سامھون اچي ٿو آبي مرحلو، جيڪو آبي محلول (يعني پاڻيءَ ۾) ۾ ڦهليل (حل ٿيل) مادي جي حالت آھي.
گهٽ واقف مرحلن ۾، پلازما، بوس-آئنسٽائن ڪنڊينسيٽس ۽ فرميونڪ ڪنڊينسيٽس ۽ مقناطيسي مواد جا پيرا مقناطيسي ۽ فيرومگنيٽڪ مرحلا شامل آهن. جڏهن ته سڀ کان وڌيڪ واقف مرحلا ٽن-طول عرض (3D) نظام سان تعلق رکڻ ٿا، اهو پڻ ممڪن آهي ته اينالاگز کي ٻه-طول عرض (2D) نظام ۾ بيان ڪيو وڃي، جنهن کي حياتيات ۾ نظام سان لاڳاپيل هجڻ لاء ڌيان ڏنو ويو آهي.
بانڊنگ
- اصل مضمون جي لاءِ ڏسو ڪيميائي بانڊ
ايٽم جيڪي ماليڪيولز يا ڪرسٽل ۾ پاڻ ۾ گڏ هوندا آهن انهن کي چيو ويندو آهي ته هڪ ٻئي سان ڳنڍيل آهن. هڪ ڪيميائي بانڊ نيوڪليس ۾ مثبت چارجن ۽ انهن جي باري ۾ لڳل منفي چارجن جي وچ ۾ گھڻ قطب توازن تصور ڪري سگهجي ٿو.[15] سادي ڪشش ۽ تڪرار کان وڌيڪ، توانائي ۽ تقسيم هڪ اليڪٽران جي موجودگي کي ٻئي ايٽم سان بانڊ ڪرڻ جي خاصيت ڪن ٿا.
ڪيميائي بانڊ هڪ ڪوويلنٽ بانڊ، آئني بانڊ، هائيڊروجن بانڊ يا صرف وان ڊر وال فورس جي ڪري ٿي سگهي ٿو. انهن مان هر هڪ قسم جي بانڊن کي ڪجهه صلاحيت سان منسوب ڪيو ويو آهي. اهي صلاحيتون رابطي کي ٺاهيندا آهن جيڪي ائٽم کي ماليڪيول يا ڪرسٽل ۾ گڏ ڪن ٿيون. ڪيترن ئي سادي مرڪبن ۾، ويلنس بانڊ جو نظريو، ويلنس شيل اليڪٽران پيئر ريپلشن ماڊل (VSEPR) ۽ آڪسائيڊشن نمبر جو تصور ماليڪيولر ڍانچي ۽ ساخت جي وضاحت لاءِ استعمال ڪري سگھجي ٿو.
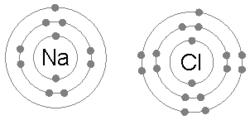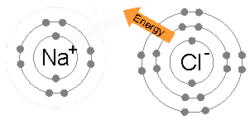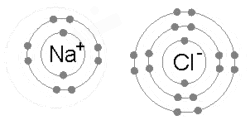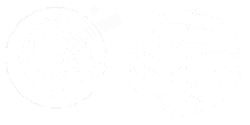
هڪ آئنڪ بانڊ ٺهي ٿو جڏهن هڪ ڌاتو پنهنجي هڪ يا وڌيڪ اليڪٽرانن کي وڃائي ٿو، هڪ مثبت طور تي چارج ٿيل ڪيٽ آئن بڻجي ٿو ۽ اليڪٽران وري غير ڌاتو ايٽم ذريعي حاصل ڪيا ويندا آهن، هڪ منفي طور تي چارج ٿيل اين آئن بڻجي ويندا آهن. ٻه متضاد چارج ٿيل آئن هڪ ٻئي کي متوجه ڪن ٿا ۽ آئنڪ بانڊ انهن جي وچ ۾ ڪشش جي برقياتي قوت آهي. مثال طور، سوڊيم (Na)، هڪ ڌاتو، هڪ اليڪٽران وڃائي ڪيٽ آئن Na+ بڻجي وڃي ٿو، جڏهن ته کلورين (Cl)، هڪ غير ڌاتو، هن اليڪٽران کي حاصل ڪري اين آئن Cl− بڻجي ٿو. آئنز اليڪٽروسٽيٽڪ ڪشش جي ڪري گڏ ٿين ٿا ۽ اهو مرڪب سوڊيم ڪلورائڊ (NaCl)، يا عام ٽيبل لوڻ، ٺاهي ٿو.

هڪ ڪوويلنٽ بانڊ ۾، ويلنس اليڪٽرانن جو هڪ يا وڌيڪ جوڙو ٻن ايٽمن پاران ورهايو ويندو آهي: بانڊ ٿيل ايٽمن جي نتيجي ۾ برقي طور تي غير جانبدار گروپ کي ماليڪيول سڏيو ويندو آهي. ايٽم ويلنس اليڪٽرانن کي اهڙي طرح شيئر ڪندا جيئن هر ايٽم لاءِ هڪ نوبل گيس اليڪٽران جي ترتيب (پنهنجي ٻاهرئين شيل ۾ اٺ اليڪٽران) ٺاهي. ايٽم جيڪي اهڙيءَ طرح گڏ ٿين ٿا ته انهن مان هر هڪ جي ويلنس شيل ۾ اٺ اليڪٽران آهن، انهن کي چيو ويندو آهي ته اهي آڪٽٽ قاعدي جي پيروي ڪندا آهن. بهرحال، ڪجهه عنصرن جهڙوڪ هائڊروجن ۽ ليٿيم کي پنهنجي ٻاهرئين شيل ۾ صرف ٻن اليڪٽرانن جي ضرورت هوندي آهي ته جيئن هن هڪ مستحڪم جوڙجڪ کي حاصل ڪري سگهجي. انهن ائٽمن کي چيو ويندو آهي ته اهي ڊيوٽ قاعدي جي پيروي ڪندا آهن ۽ اهڙي طرح اهي نوبل گيس هيليم جي اليڪٽران جي ترتيب تائين پهچي رهيا آهن، جنهن جي ٻاهرئين شيل ۾ ٻه اليڪٽران آهن.
اهڙي طرح، ڪيترن ئي آئني ساختن جي اڳڪٿي ڪرڻ لاءِ ڪلاسيڪل فزڪس جا نظريا استعمال ڪري سگھجن ٿا. وڌيڪ پيچيده مرڪبن سان، جهڙوڪ ڌاتو ڪمپليڪس، والنس بانڊ نظريو گهٽ لاڳو ٿئي ٿو ۽ متبادل طريقا، جهڙوڪ ماليڪيولر آربيٽل ٿيوري، عام طور تي استعمال ٿيندا آهن. اليڪٽرانڪ مدار تي ڊاگرام ڏسو.
توانائي
- اصل مضمون جي لاءِ ڏسو توانائي
ڪيمسٽريءَ جي حوالي سان، توانائي ڪنهن مادي جي هڪ خاصيت آهي، جيڪا ان جي ايٽمي، ماليڪيولر يا مجموعي ڍانچي جو نتيجو آهي. جيئن ته هڪ ڪيميائي ڦيرڦار انهن مان هڪ يا وڌيڪ ساختن ۾ تبديلي سان گڏ هوندو آهي، اهو هميشه مادي جي توانائي جي واڌ يا گهٽتائي سان گڏ هوندو آهي. ڪجهه توانائي رد عمل جي چوڌاري ۽ ري ايڪٽينٽن (reactants) جي وچ ۾ گرمي ۽ روشني جي شڪل ۾ منتقل ڪيو ويندو آهي. اهڙيء طرح هڪ رد عمل جي پيداوار (product)، ري ايڪٽينٽن جي ڀيٽ ۾، وڌيڪ يا گهٽ توانائي واري ٿي سگهي ٿي.
هڪ ردعمل کي ايڪزرگونڪ (exergonic) چيو ويندو آهي، جيڪڏهن حتمي حالت ابتدائي حالت کان توانائي جي پيماني تي گهٽ آهي؛ اينڊرگونڪ (endergonic) ردعمل جي صورت ۾ صورتحال ان جي ابتڙ آهي. هڪ ڪيميائي عمل ايڪزوٿرمڪ (exothermic) چيو ويندو آهي جيڪڏهن ردعمل ماحول کي گرمي جاري ڪري ٿو. اينڊوٿرمڪ (endothermic) ردعمل جي صورت ۾، ردعمل ماحول مان گرمي جذب ڪري ٿو.
ڪيميائي رد عمل هميشه ممڪن نه هوندا آهن جيستائين ريڪٽينٽ هڪ توانائي جي رڪاوٽ کي ختم نه ڪن جنهن کي "فعال ڪرڻ واري توانائي" (Activation Energy) طور سڃاتو وڃي ٿو. ڪيميائي ردعمل جي رفتار (ڏسايل درجه حرارت، T تي) ايڪٽيويشن توانائي، E سان لاڳاپيل آهي، بولٽزمان جي آبادي جي عنصر طرفان؛ يعني هڪ ماليڪيول جي ڏنل درجه حرارت T تي E کان وڌيڪ يا ان جي برابر توانائي هجڻ جو امڪان آهي. درجه حرارت تي رد عمل جي شرح جو اهو اضطراري انحصار آرهينيئس مساوات طور سڃاتو وڃي ٿو. ڪيميائي رد عمل ٿيڻ لاءِ چالو ڪرڻ واري توانائي، گرمي، روشني، بجلي يا مشيني قوت جي صورت ۾ الٽراسائونڊ جي صورت ۾ ٿي سگهي ٿي.[16]
هڪ لاڳاپيل تصور آزاد توانائي، جنهن ۾ اينٽراپي غورن کي پڻ شامل ڪيو ويو آهي، هڪ رد عمل جي فزيبلٽي جي اڳڪٿي ڪرڻ ۽ ڪيميائي رد عمل جي توازن جي حالت کي طئي ڪرڻ لاء، ڪيميائي ٿرموڊائنامڪس ۾ هڪ تمام مفيد ذريعو آهي. هڪ ردعمل ممڪن آهي صرف ان صورت ۾ جڏهن "گب جي آزاد توانائي" ۾ مجموعي تبديلي منفي آهي؛ ، جيڪڏهن اهو صفر جي برابر آهي ته ڪيميائي رد عمل کي توازن ۾ چيو ويندو آهي.
اليڪٽران، ايٽم ۽ ماليڪيولز لاءِ توانائي جون صرف محدود ممڪن حالتون موجود آهن. اهي ڪوانٽم ميڪنڪس جي قاعدن سان طئي ڪيا ويا آهن، جن کي پابند نظام جي توانائي جي مقدار جي ضرورت آهي. وڌيڪ توانائي واري حالت ۾ ائٽم/ ماليڪيولز کي پرجوش چئبو آهي. پرجوش توانائي واري حالت ۾ مادي جا ماليڪيول/ايٽم گهڻو ڪري وڌيڪ رد عمل وارا هوندا آهن، يعني ڪيميائي عمل لاء وڌيڪ قابل هوندا آهن.
مادي جو مرحلو هميشه ان جي توانائي ۽ ان جي آس پاس جي توانائي سان طئي ڪيو ويندو آهي. جڏهن ڪنهن مادي جون وچولي قوتون اهڙيون هونديون آهن ته ماحول جي توانائي انهن تي قابو پائڻ لاءِ ڪافي نه هوندي آهي، ته اها وڌيڪ ترتيب واري مرحلي ۾ ٿيندي آهي جيئن مائع يا جامد. پاڻي (H2O) جي صورت ۾، ڪمري جي حرارت تي هڪ پاڻي مائع صورت ۾ هوندو آهي، ڇاڪاڻ ته ان جا ماليڪيول هائڊروجن بانڊ سان جڙيل آهن. [17] جڏهن ته هائيڊروجن سلفائيڊ (H2S) ڪمري جي گرمي پد ۽ معياري دٻاءُ تي هڪ گئس آهي، ڇاڪاڻ ته ان جا ماليڪيول ڪمزور ڊائيپول-ڊائيپول رابطي سان جڙيل آهن.
هڪ ڪيميائي مادو کان ٻئي کي توانائي جي منتقلي جو دارومدار انرجي ڪوانٽا جي ماپ تي آهي جيڪو هڪ مادي مان خارج ٿئي ٿو. بهرحال، گرمي جي توانائي اڪثر ڪري وڌيڪ آساني سان تقريبا ڪنهن به مادو کان ٻئي ڏانهن منتقل ڪيو ويندو آهي ڇاڪاڻ ته فوٽون هڪ مادي ۾ متحرڪ ۽ گردش توانائي جي سطحن لاء ذميوار آهن، برقي توانائي جي منتقلي لاء فوٽون جي ڀيٽ ۾ تمام گهٽ توانائي آهي. اهڙيء طرح، ڇاڪاڻ ته متحرڪ ۽ گردش توانائي جي سطح برقي توانائي جي سطحن جي ڀيٽ ۾ وڌيڪ ويجھي فاصلي تي آهن، گرمي وڌيڪ آساني سان مادي جي وچ ۾ روشني يا برقي توانائي جي ٻين شڪلن جي وچ ۾ منتقل ٿي ويندي آهي. مثال طور، الٽرا وائلٽ برقياتي مقناطيسي تابڪاري ايتري افاديت سان منتقل نه ٿيندي آهي جيترو هڪ مادو کان ٻئي ۾ حرارتي يا برقي توانائي.
مختلف ڪيميائي مادن لاءِ خصوصيت واري توانائي جي سطح جو وجود، اسپيڪٽرل لائينن جي تجزيي سان، انهن جي سڃاڻپ لاءِ ڪارائتو آهي. مختلف قسم جا اسپيڪٽرا اڪثر ڪري ڪيميائي اسپيڪٽرو اسڪوپي ۾ استعمال ٿيندا آهن، مثال طور IR، مائڪرو ويو، NMR ۽ ESR وغيره. اسپيڪٽرو اسڪوپي پڻ بيروني شين جي ساخت جي سڃاڻپ ڪرڻ لاءِ - جهڙوڪ تارا ۽ پري ڪهڪشان - انهن جي تابڪاري اسپيڪٽرا جو تجزيو ڪندي، استعمال ڪئي ويندي آهي.

ڪيميائي توانائي جو اصطلاح اڪثر ڪري ڪيميائي مادي جي صلاحيت کي ظاهر ڪرڻ لاءِ جيڪو ڪيميائي رد عمل ذريعي يا ٻين ڪيميائي مادن کي تبديل ڪرڻ لاءِ هوندي آهن، استعمال ڪيو ويندو آهي.
رد عمل
- اصل مضمون جي لاءِ ڏسو ڪيميائي عمل

جڏهن ڪو ڪيميائي مادو، ان جي ڪنهن ٻئي مادي يا توانائي سان رابطي جي نتيجي ۾ تبديل ٿئي ٿو ته هي هڪ ڪيميائي رد عمل چيو ويندو آهي. ڪيميائي رد عمل ان ڪري هڪ تصور آهي جيڪو ڪنهن مادي جي "رد عمل"، جڏهن اهو ڪنهن ٻئي سان ويجهي رابطي ۾ اچي ٿو، چاهي هڪ مڪسچر يا محلول جي طور تي؛ توانائي جي ڪجهه شڪل جي نمائش، يا ٻئي، سان لاڳاپيل آهي. ان جي نتيجي ۾ ردعمل جي اجزاء جي وچ ۾ ڪجهه توانائي جي بدلي سان گڏوگڏ سسٽم جي ماحول سان گڏ، جيڪا خاص ٺهيل ويسل هوندا آهن- اڪثر ليبارٽري شيشي جو سامان هوندو آهي.
ڪيميائي رد عملن جي نتيجي ۾ ماليڪيولن ٺهڻ يا الڳ ٿيڻ ٿا، يعني ماليڪيول ٻه يا وڌيڪ ماليڪيول ٺاهڻ يا ماليڪيولن جي اندر يا ان ۾ ايٽم جي ٻيهر ترتيب ڏيڻ لاء ٽٽڻ يا الگ ٿيندا آهن. ڪيميائي ردعمل ۾ عام طور تي ڪيميائي بانڊ ٺاهڻ يا ٽوڙڻ شامل آهن. آڪسيڊيشن، گھٽتائي، جداگي، تيزاب-اساس غير جانبداري ۽ ماليڪيولر ٻيهر ترتيب ڏيڻ عام ڪيميائي رد عمل جا ڪجهه مثال آهن.
هڪ ڪيميائي ردعمل کي علامتي طور تي ڪيميائي مساوات ذريعي ظاهر ڪري سگهجي ٿو. جڏهن ته هڪ غير ائٽمي ڪيميائي رد عمل ۾ مساوات جي ٻنهي پاسن تي ايٽمن جو تعداد ۽ قسم برابر هوندا آهن، ايٽمي ردعمل لاء اهو صرف نيوڪليئر ذرڙن، پروٽان ۽ نيوٽران لاء صحيح آهي.[18]
قدمن جو تسلسل جنهن ۾ ڪيميائي بانڊن جي ٻيهر جوڙجڪ ٿي سگهي ٿي ڪيميائي رد عمل جي دوران، ان کي ميڪانيزم سڏيو ويندو آهي. هڪ ڪيميائي رد عمل ڪيترن ئي مرحلن ۾ ٿيڻ، جن مان هر هڪ مختلف رفتار ٿي سگهي ٿو، لاء تصور ڪري سگهجي ٿو. متغير استحڪام سان ڪيترائي ردعمل وچولي اهڙيء طرح رد عمل جي دوران تصور ڪري سگهجي ٿو. رد عمل جي ميکانيزم کي وضاحت ڪرڻ لاءِ ڪائينيٽڪس ۽ هڪ ردعمل جي لاڳاپي پيداوار جي ميلاپ کي، تجويز ڪيو ويو آهي. ڪيترائي طبيعي ڪيميادان مختلف ڪيميائي رد عمل جي ميڪانيزم کي ڳولڻ ۽ تجويز ڪرڻ ۾ خاص مهارت حاصل ڪن ٿا. ڪيترائي تجرباتي ضابطا، جهڙوڪ ووڊورڊ-هافمن جا ضابطا، اڪثر ڪم ۾ ايندا آهن جڏهن ته ڪيميائي رد عمل لاءِ هڪ ميکانيزم تجويز ڪيو ويندو آهي.
IUPAC گولڊ بڪ جي مطابق، هڪ ڪيميائي رد عمل
"هڪ ڪيميائي عمل ڪيميائي شين جي آپس ۾ تبديلي جو عمل آهي."[19]
ان جي مطابق، هڪ ڪيميائي رد عمل هڪ ابتدائي رد عمل يا هڪ قدم وار ردعمل ٿي سگهي ٿو. هڪ اضافي احتياط ڪيو ويو آهي، جنهن ۾ هن تعريف ۾ اهي ڪيس شامل آهن جتي ڪنفارمرز جي وچ ۾ تبديلي تجرباتي طور تي مشاهدو آهي. اهڙي قسم جي سڃاڻپ ڪندڙ ڪيميائي رد عملن ۾ عام طور تي ماليڪيولر ادارن جا سيٽ شامل هوندا آهن جيئن هن وصف مان ظاهر ڪيو ويو آهي، پر اهو اصطلاح استعمال ڪرڻ اڪثر تصوراتي طور تي آسان هوندو آهي ته انهن تبديلين لاءِ پڻ استعمال ڪيو وڃي جنهن ۾ واحد ماليڪيولر ادارا (يعني ’مائڪرو اسڪوپي ڪيميائي واقعا‘) شامل ٿيڻ ٿا.
آئن ۽ سالٽ

- اصل مضمون جي لاءِ ڏسو آئن
هڪ آئن هڪ چارج ٿيل اينٽيٽي، هڪ ائٽم يا هڪ ماليڪيول، آھي جيڪو هڪ يا وڌيڪ اليڪٽران وڃائي يا حاصل ڪري چڪو هوندو آهي. جڏهن هڪ ائٽم هڪ اليڪٽران وڃائي ٿو ۽ اهڙيء طرح اليڪٽرانن کان وڌيڪ پروٽون ٿي ويندا آهن، ايٽم هڪ مثبت طور تي چارج ٿيل آئن يا ڪيٽ آئن (Cation) آهي. جڏهن هڪ ائٽم هڪ اليڪٽران حاصل ڪري ٿو ۽ اهڙيء طرح پروٽان کان وڌيڪ اليڪٽران ٿي ويندا آهن، ايٽم هڪ منفي طور تي چارج ٿيل آئن يا اين آئن (Anion) آهي. ڪيٽ آئنز ۽ اين آئن غيرجانبدار لوڻ جي هڪ ڪرسٽل جال ٺاهي سگهن ٿا، جهڙوڪ Na+ ۽ Cl− آئن، سوڊيم کلورائڊ (NaCl) ۾ ٺاهيندا آهن. پولي ايٽمي آئنز جا مثال جيڪي تيزاب-اساس عمل دوران ورهائي نه ٿا وڃن، اها هائيڊروڪسائيڊ (OH−) ۽ فاسفيٽ (PO43−) آهن.
پلازما گيس جي مادي جو ٺهيل آهي جيڪو عام طور تي تيز گرمي جي ذريعي، مڪمل طور تي آئنائيز ڪيو ويو آهي.
تيزابيت ۽ اساسيت

- اصل مضمون جي لاءِ ڏسو تيزابي-اساسي ردعمل
مادي کي اڪثر ڪري تيزاب (Acid) يا اساس (Base) جي طور تي درجه بندي ڪري سگهجي ٿو. اتي ڪيترائي مختلف نظريا آھن جيڪي تيزاب-اساس رويي جي وضاحت ڪن ٿا. سڀ کان سادو آرهينيئس (Arrhenius) جو نظريو آهي، جنهن ۾ چيو ويو آهي ته تيزاب هڪ اهڙو مادو آهي جيڪو هائيڊرونيم آئنز (+ H) پيدا ڪري ٿو جڏهن اهو پاڻي ۾ ڦهلجي وڃي ٿو ۽ هڪ اساس اهو آهي جيڪو پاڻي ۾ ڦهليل هائيڊروڪسائيڊ آئن (- OH) پيدا ڪري ٿو. برونسٽيد-لوري تيزاب-اساس نظريي ( Brønsted-Lowry acid-base theory) جي مطابق، تيزاب اهڙا مادا آهن جيڪي هڪ مثبت هائيڊروجن آئن کي ڪيميائي عمل ۾ ڪنهن ٻئي مادي کي عطيو ڪندا آهن؛ هن جي توسيع جي ذريعي، اساس اهڙو مادو آهي جيڪا هائيڊروجن آئن (+ H) حاصل ڪري ٿي.
هڪ ٽيون عام نظريو ليوس تيزاب-اساس نظريو آهي، جيڪو نئين ڪيميائي بانڊن جي ٺهڻ تي ٻڌل آهي. ليوس نظريو وضاحت ڪري ٿو ته هڪ تيزاب هڪ اهڙو مادو آهي جيڪو بانڊ ٺهڻ جي عمل دوران ڪنهن ٻئي مادي مان اليڪٽرانن جو هڪ جوڙو قبول ڪرڻ جي قابل هوندو آهي، جڏهن ته اساس هڪ اهڙو مادو آهي جيڪو هڪ نئون بانڊ ٺاهي اليڪٽرانن جو هڪ جوڙو مهيا ڪري سگهي ٿو. اتي ٻيا به ڪيترائي طريقا آھن جن ۾ ھڪڙي مادي کي تيزاب يا اساس جي طور تي درجه بندي ڪري سگھجي ٿو، جيئن ھن تصور جي تاريخ ۾ واضح آھي.[20]
تيزابي طاقت عام طور تي ٻن طريقن سان ماپي ويندي آهي. هڪ ماپ، تيزابيت جي آرهينيئس جي تعريف جي بنياد تي، pH آهي، جيڪو هڪ حل ۾ هائيڊرونيم آئن ڪنسنٽريشن جي ماپ آهي، جيئن منفي لاگارٿمڪ اسڪيل تي ظاهر ڪيو ويو آهي. اهڙيء طرح، حل جيڪي گهٽ pH آهن هڪ اعلي هائيڊرونيم آئن ڪنسنٽريشن آهي ۽ وڌيڪ تيزابي چئي سگهجي ٿو. ٻي ماپ، برونسٽيد-لوري جي تعريف جي بنياد تي، تيزاب جي الگ ٿيڻ جو مسلسل (Ka) آهي، جيڪو تيزاب جي برونسٽيد-لوري وصف تحت تيزاب طور ڪم ڪرڻ لاءِ مادي جي لاڳاپي جي صلاحيت کي ماپي ٿو. اهو هي آهي ته، اعليٰ (Ka) سان مادو انهن کي ڪيميائي رد عمل ۾ هائڊروجن آئن جو عطيو ڏيڻ جو امڪان وڌيڪ هوندو آهي انهن جي ڀيٽ ۾ جيڪي گهٽ (Ka) قدرن سان آهن.
ريڊوڪس
- اصل مضمون جي لاءِ ڏسو ريڊڪشن-آڪسيڊيشن
ريڊوڪس (Redox) يا ريڊڪشن-آڪسيڊيشن (Reduction-oxidation) عمل ۾ سڀئي ڪيميائي رد عمل شامل آهن جن ۾ ايٽم پنهنجي آڪسائيڊ حالت کي تبديل ڪري ڇڏيو آهي يا ته اليڪٽران حاصل ڪرڻ (گهٽائي) يا اليڪٽرانن کي وڃائڻ (آڪسائيڊيشن). اهي شيون جيڪي ٻين مادن کي آڪسائيڊ ڪرڻ جي صلاحيت رکن ٿيون انهن کي آڪسائيڊائٽي چئبو آهي ۽ آڪسائيڊنگ ايجنٽ، آڪسائيڊينٽس يا آڪسائيڊائزر طور سڃاتو وڃي ٿو. هڪ آڪسائيڊٽ ٻئي مادي مان اليڪٽران ڪڍي ٿو. اهڙي طرح، اهي شيون جيڪي ٻين مادي کي گھٽائڻ جي صلاحيت رکن ٿيون انهن کي گھٽائيندڙ چيو ويندو آهي ۽ انهن کي گهٽائيندڙ ايجنٽ، ريڊڪٽينٽ، يا گهٽائيندڙ طور سڃاتو وڃي ٿو. ھڪڙو گھٽائڻ وارو اليڪٽران ٻئي مادي ڏانھن منتقل ڪري ٿو ۽ اھڙيء طرح پاڻ کي آڪسائيڊ ڪيو ويو آھي. ۽ ڇاڪاڻ ته اهو "عطيو" اليڪٽران ان کي پڻ سڏيو ويندو آهي اليڪٽران ڊونر. آڪسائيڊشن ۽ گهٽتائي صحيح طور تي آڪسائيڊشن نمبر ۾ تبديلي ڏانهن اشارو ڪري ٿو- اليڪٽران جي حقيقي منتقلي ڪڏهن به نه ٿي سگهي ٿي. اهڙيء طرح، آڪسائيڊشن بهتر طور تي بيان ڪيو ويو آهي آڪسائيڊشن نمبر ۾ اضافو، ۽ گهٽتائي آڪسائيڊشن نمبر ۾ گهٽتائي جي طور تي.
توازن
- اصل مضمون جي لاءِ ڏسو ڪيميائي توازن
جيتوڻيڪ توازن (equilibrium) جو تصور سائنس ۾ وڏي پيماني تي استعمال ٿئي ٿو، ڪيميا جي حوالي سان، اهو تڏهن پيدا ٿئي ٿو جڏهن ڪيميائي ساخت جي مختلف رياستن جو هڪ انگ ممڪن آهي، مثال طور، ڪيترن ئي ڪيميائي مرکبن جي ميلاپ ۾ جيڪي هڪ ٻئي سان رد عمل ڪري سگهن ٿا، يا جڏهن هڪ مادي هڪ کان وڌيڪ قسم جي مرحلي ۾ موجود ٿي سگهي ٿي. ڪيميائي مادن جو هڪ نظام توازن ۾، جيتوڻيڪ هڪ غير تبديل ٿيندڙ جوڙجڪ هجڻ جي باوجود، اڪثر ڪري جامد نه آهي؛ مادي جا ماليڪيول هڪ ٻئي سان رد عمل ڪندا رهندا آهن اهڙيءَ طرح هڪ متحرڪ توازن کي جنم ڏئي ٿو. اهڙيءَ طرح اهو تصور رياست کي بيان ڪري ٿو جنهن ۾ پيرا ميٽرز جهڙوڪ ڪيميائي ساخت وقت سان گڏ اڻڄاتل رهي ٿو.
ڪيميائي قانون
- اصل مضمون جي لاءِ ڏسو ڪيميائي قانون
ڪيميائي تعمل ڪجهه قانونن جي تحت عمل ۾ اچڻ ٿا، جيڪا ڪيميا ۾ بنيادي تصور بڻجي ويا آهن. انهن مان ڪجهه هي آهن:
- ايووگاڊرو جو قانون
- بيئر-ليمبرٽ قانون
- بوائل جو قانون (1662، دٻاء ۽ حجم سان لاڳاپيل)
- چارلس جو قانون (1787، حجم ۽ گرمي سان لاڳاپيل)
- فِڪ (گراهم) جي پکيڙ جا قانون. * گي-لوساڪ جو قانون (1809)، دٻاء ۽ گرمي سان لاڳاپيل
- ڊالٽن جو جزوي دٻاء جو قانون
- لي شيٽيلير جو اصول
- هنري جو قانون
- هيس جو قانون
- ارهينيئس جو تيزاب ۽ اساس جو نظريو
- توانائي جي تحفظ جو قانون: هي قانون توازن، حرڪيات ۽ ٿرموڊائنامڪس جي اهم تصورن ڏانهن وٺي ٿو.
- ڪميت (Mass) جي تحفظ جو قانون الڳ الڳ نظامن ۾، جديد فزڪس ۾ به محفوظ رهيو آهي. جڏهن ته، خاص نسبت ڏيکاري ٿي ته ماس-انرجي جي برابريءَ جي ڪري، جڏهن به غير مادي ”توانائي“ (گرمي، روشني، متحرڪ توانائي) کي ڪنهن غير الڳ ٿيل نظام مان ڪڍيو ويندو آهي، ته ان سان گڏ ڪجهه ماس به ضايع ٿي ويندو. اعلي توانائي جي نقصان جي نتيجي ۾ وزن جي مقدار جي نقصان جي نتيجي ۾، ايٽمي ڪيمسٽري ۾ هڪ اهم موضوع.
- قطعي ترتيب جو قانون، جيتوڻيڪ ڪيترن ئي نظامن ۾ (خاص طور تي حياتياتي وڏي موليڪيولن ۽ معدنيات) نسبتن کي وڏي تعداد جي ضرورت هوندي آهي ۽ اڪثر ڪري هڪ ڀاڱي جي طور تي پيش ڪيو ويندو آهي.
- گھڻن تناسب جو قانون
- راولٽ جو قانون
ڪيمسٽري جون شاخون
نامياتي ڪيميا
ڪيمسٽري جي ھن شاخ ۾ اھڙن مرڪبن جو اڀياس ڪيو ويندو آهي جن کي ڪاربن ۽ ھائيڊروجن چوندا آھن. مثال: پيٽرول، پلاسٽڪ وغيره.
غير نامياتي ڪيميا
اھو علم اھڙن مرڪبن ۽ عنصرن جي باري ۾ آهي جيڪي غير نامياتي شين مان ملن ٿا. ھن علم ۾ ڪاربن جي ڪيترن ئي مرڪبن کان علاوه باقي سمورن عنصرن ۽ انھن جي مرڪبن جو اڀياس شامل آھي.
طبعي ڪيميا
ڪيمسٽري جي ھن شاخ ۾ ڪنھن ڪيميائي عمل دوران ماليڪيول ۽ ايٽمن جي وچ ۾ موجود اصولن ۽ نظرين بابت اڀياس شامل ھوندو آھي.
تجزياتي ڪيميا
ڪيمسٽري جي ھن شاخ ۾ اھڙن طريقن ۽ عملن جو اڀياس ڪيو ويندو آهي جن سان عنصرن ۽ مرڪبن جو تجزيو ڪيو ويندو آهي.
حياتياتي ڪيميا
جاندارن ۾ موجود مادن جو اڀياس حياتياتي ڪيميا سڏبو آهي.
نيوڪليائي ڪيميا
تابڪاري وارن عنصرن جي ايٽمن ۾ ٿيڻ وارين تبديلين ۽ انھن مان شعاعن جي نيڪال بابت اڀياس کي نيوڪليائي ڪيمسٽري چوندا آهن.
صنعتي ڪيميا
مختلف صنعتي شين جھڙوڪ شيشو، سيمنٽ، ڪاغذ، دوائون ۽ ھٿرادو ڀاڻ وغيره ٺاهڻ جي مرحلن جي اڀياس کي صنعتي ڪيمسٽري چوندا آهن.
ماحولياتي ڪيميا
صنعتي ڪيميائي مادن جي زندگيءَ تي پوندڙ اثرن جو اڀياس.
پوليمر ڪيميا
جڏھن پنج يا وڌيڪ ماليڪيول پاڻ ۾ اھڙي طرح ڪيميائي عمل ڪن جو ھڪ بعد ٻيو لڙھي جي شڪل اختيار ڪري ته ان کي پوليمرائيزيشن چوندا آهن. ھي علم اسان کي پلاسٽڪ، مصنوعي ريشا (synthetic fibers) ۽ ڪاغذ وغيره جھڙين شين جي معلومات ڏئي ٿو.
پڻ ڏسو
- مشھور ڪيميا دانن جي فهرست
- ڪيميائي مرڪبن جي فهرست
خارجي ڳنڍڻا
| علم ڪيميا بابت وڌيڪ ڏسو وڪيپيڊيا جي ڀينر رٿائن ۾: | |
| معني ڏسو وِڪِشنري تي | |
| تصويرون ۽ وڊيو ڏسو وڪي ڪامنز تي | |
| نيوز اسٽوريز وڪي نيوز تان | |
| چَوِڻيون Quotations وڪي ڪوٽ تان | |
| سورس ٽيڪسٽس وڪي سورس تان | |
| درسي ڪتاب وڪي ڪتاب تان | |
حوالا
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.








