Loading AI tools
Из Википедии, свободной энциклопедии
Xist (англ. X-inactive specific transcript) — ген, кодирующий РНК и локализованный на Х-хромосоме плацентарных млекопитающих, является ключевым эффектором в инактивации Х-хромосомы[5]. Он входит в состав комплекса Xic (англ. X-chromosome inactivation centre)[6], наряду с двумя другими РНК-кодирующими генами (Jpx[англ.] и Ftx[англ.]) и двумя белоккодирующими генами (Tsx и Cnbp2)[7]. Продукт гена Xist — Xist-РНК — представляет собой крупный транскрипт (17 кб у человека)[8], который экспрессируется на неактивной хромосоме и не экспрессируется на активной. Процессинг этого транскрипта напоминает процессинг мРНК и тоже включает этапы сплайсинга (в т. ч. альтернативного[5]) и полиаденилирования, однако он остаётся в ядре и не транслируется. Было высказано предположение, что ген Xist по крайней мере частично образовался как часть белоккодирующего гена, который впоследствии стал псевдогеном[9]. Инактивированная Х-хромосома покрыта Xist-РНК, который необходим для процесса инактивации[10]. Х-хромосома, лишённая гена Xist, не будет инактивирована, однако дупликация этого гена на другой хромосоме вызывает инактивацию и первой хромосомы тоже[11].
| Xist | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | XIST, DXS1089, DXS399E, LINC00001, NCRNA00001, SXI1, swd66, X inactive specific transcript (non-protein coding), X inactive specific transcript, Xist | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние ID | OMIM: 314670 MGI: 98974 GeneCards: XIST | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Инактивация Х-хромосомы, которая происходит на ранних стадиях развития самок плацентарных млекопитающих, обеспечивает сайленсинг на уровне транскрипции одной из двух Х-хромосом, что обеспечивает дозовое равенство (т. е. по количеству активных вариантов одного гена) самок и самцов (см. подробнее «Дозовая компенсация»). Функциональная роль Xist-РНК была наглядно продемонстрирована на эмбриональных стволовых клетках самок мышей. В ходе этих экспериментов введение в клетки антисмысловой РНК длиной 19 нуклеотидов, мишенью которой была Xist-РНК, предотвращало образование Xic и цис-сайленсинг Х-связанных генов. Впрочем, в дальнейшем было показано, что инактивация Х-хромосомы у мышей всё-таки происходит даже в отсутствие гена Xist посредством эпигенетической регуляции, но Xist-РНК необходима для стабилизации такого сайленсинга[12].
Было показано, что ген Xist взаимодействует с геном BRCA1, связанным с раком молочной железы[13][14].
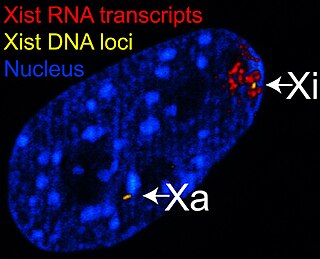
У человека ген Xist локализован на длинном (q) плече Х-хромосомы. Он включает в себя большое количество повторов[8] и состоит из А-региона, содержащего 8 повторов, разделённых U-спейсерами. А-регион содержит две крупные шпильки, в каждую из которых входит по 4 повтора[15]. Ортолог гена Xist у человека был идентифицирован у мыши, его длина составляет 15 кб, однако он не содержит консервативных повторов[16].

Xist-РНК состоит из двух регионов: А и С. Консервативный А-регион содержит до 9 повторяющихся элементов[15]. Недавно было показано, что у мыши и человека А-регион Xist-РНК состоит из двух длинных шпилек, в состав каждой из которых входит по 4 повтора[8][15]. Хотя конкретная функция А-региона неизвестна, было показано, что он необходим для эффективного связывания с белком Suz12[англ.][15].
Связывание Xist-РНК с инактивированной Х-хромосомой осуществляется через хроматин-связывающий участок, расположенный на самом транскрипте. Впервые такой участок на Xist-РНК был описан в фибробластах самки мыши. Он оказался локализованным в области С-повтора. Вышеописанные эксперименты по введению в клетки 19-нуклеотидной антисмысловой РНК, комплементарной Xist, нарушали связывание этого транскрипта с гистоном H2A[англ.][17].

Как упоминалось выше, ген Xist-РНК входит в состав инактивационного центра Xic (англ. X Inactivation Center)[18]. Xic локализуется на q-плече Х-хромосомы (Xq13). Ключевую роль в инактивации Х-хромосомы играет промотор Xist, входящий в состав Xiс[19]. Кроме гена Xist, в Xic входит также ген Tsix[англ.], антисмысловой по отношению к Xist. Антисмысловые транскрипты гена Xist действуют как цис-регуляторы транскрипции Xist, понижая экспрессию этого гена. Механизм такой цис-регуляции экспрессии Xist с помощью Tsix пока плохо понятен, хотя существует несколько объясняющих гипотез. Согласно одной из них, Tsix участвует в модификации хроматина в локусе Xist[20] (подробнее об этом см. ниже).
Предполагается, что антисмысловой транскрипт Tsix активирует ДНК-метилтрансферазы, которые метилируют промотор Xist, что приводит к подавлению этого промотора и, следовательно, экспрессии гена Xist[21]. Показана роль ацетилирования гистонов в регуляции Xist[22].
Возможно, двуцепочечные РНК и интерферирующие РНК также играют роль в регуляции промотора Xist. По-видимому, фермент Dicer, специализирующийся на разрезании двуцепочечных РНК, разрезает дуплекс Xist и Tsix в начале процесса инактивации Х-хромосомы, в результате чего образуются короткие РНК длиной около 30 нуклеотидов (xiРНК). Предполагается, что эти xiРНК репрессируют Xist на той Х-хромосоме, которая останется активной. Это предположение подтверждается экспериментом, в ходе которого в недифференцированных клетках количество эндогенного Dicer было снижено на 5 %, что привело к увеличению Xist в этих клетках[23].
По-видимому, транскрипционные факторы плюрипотентных клеток Nanog, Oct4 и Sox2[англ.] играют роль в сайленсинге гена Xist. В отсутствие Tsix в плюрипотентных клетках Xist, тем не менее, тоже репрессирован. Возможным объяснением этому может быть то, что вышеперечисленные факторы вызывают сплайсинг по интрону 1 в сайте связывания этих факторов в гене Xist, в результате чего сайт разрушается и экспрессия Xist подавляется[20]. В плюрипотентных клетках, лишённых Nanog или Oct4, уровень экспрессии Xist повышался[24].
Была показана роль репрессорного комплекса polycomb 2[англ.] (англ. Polycomb Repressor Complex 2 (PRC2)) в сайленсинге Xist независимо от Tsix, хотя конкретные механизмы этого неизвестны. PRC2 — это класс белков группы polycomb, которые вызывают триметилирование гистона Н3[англ.] по остатку лизина 27 (К27), что подавляет транскрипцию путём перестройки хроматина. Вышеупомянутый белок Suz12 входит в группу PRC2 и имеет домен цинкового пальца, который, по-видимому, связывается с молекулой РНК[25].

Процесс инактивации Х-хромосомы начинается с распространением Xist-РНК от Xic по всей хромосоме, где Xist-РНК, по-видимому, индуцирует образование и расширение области гетерохроматина. Гетерохроматин инактивированной Х-хромосомы характеризуется не только связью с Xist-РНК, но также наличием особого варианта гистона Н2А (macroH2A), гипоацетилированием гистонов Н3 и Н4[англ.], убиквитинированием гистона H2А и метилированием специфических позиций на гистоне Н3, а также метилирования ДНК. Именно комбинация подобных модификаций обусловливает большую часть инактивированной Х-хромосомы чрезвычайно невосприимчивой к транскрипции. Кроме того, способность этих модификаций к самораспространению обеспечивает поддержание инактивированного состояния Х-хромосомы в течение многих клеточных делений. Впрочем, стоит отметить, около 10 % генов на Х-хромосоме остаются транскрипционно активными[26].
Экспрессия Xist и инактивация Х-хромосомы изменяются в процессе эмбрионального развития. У мыши в раннем эмбриональном развитии существует две волны инактивации Х-хромосомы. Первая волна происходит до образования бластоцисты, и является неслучайной — в клетках зародыша инактивируется Х-хромосома, полученная от отца, то есть инактивация Х-хромосомы на этом этапе носит импринтированный характер. На стадии бластоцисты, в клетках внутренней клеточной массы, из которой формируются в дальнейшем все органы и ткани будущего организма, этот импринтинг снимается, экспрессия Xist исчезает, инактивация отцовской Х-хромосомы отменяется, и обе Х-хромосомы становятся транскрипционно активными. Недавно полученные данные показали, что в процессе реактивации Х-хромосомы участвуют антисмысловые транскрипты[27]. В формирующихся далее клетках эпибласта начинается процесс дифференцировки, и наступает вторая волна инактивации, в которой выбор инактивируемой Х-хромосомы носит случайный характер. На одной из Х-хромосом начинает экспрессироваться Xist, и эта Х-хромосома вступает в процесс инактивации. Вследствие случайного выбора инактивируемой Х-хромосомы каждый женский организм представляет собой мозаику из клональных групп клеток, у которых либо инактивирована Х-хромосома, доставшаяся от отца, либо Х-хромосома, оставшаяся от матери. Инактивация Х-хромосомы поддерживается в течение тысячи клеточных делений[26], и только в развивающихся гоноцитах экспрессия Xist снижается и Х-хромосома вновь реактивируется[28]. В экстраэмбриональных тканях у мыши импринтированная инактивация отцовской Х-хромосомы, установившаяся во время первой волны инактивации, сохраняется в течение всего эмбрионального развития.
Инактивация Х-хромосомы играет ключевую роль в механизме дозовой компенсации, благодаря которому обеспечивается равенство доз генных продуктов Х-хромосомы у обоих полов[26][29]. У различных видов дозовая компенсация обеспечивается различными путями, но во всех таких путях имеет место регуляции экспрессии Х-хромосомы у одного из двух обоих полов[29]. Если одна из двух Х-хромосом не будет инактивирована или будет частично экспрессироваться, то получающаяся в результате избыточная экспрессия Х-хромосомы может быть летальной[26].
У человека мутации в промоторе Xist обусловливают семейную неслучайную инактивацию Х-хромосомы[англ.][5].
В 2013 году было показано, что внедрение гена Xist в одну из 21-х хромосом стволовой клетки с трисомией по 21-й хромосоме (причина синдрома Дауна) позволяет инактивировать эту хромосому. Таким образом, ген Xist может лечь в основу нового подхода к лечению синдрома Дауна[30].
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.