Hsp90
Из Википедии, свободной энциклопедии
Hsp90 (сокр. от англ. Heat shock protein 90), также белок теплового шока 90 — это белок-шаперон, который помогает другим белкам правильно складываться (участвует в фолдинге), стабилизирует белки от теплового стресса и способствует деградации белка. Он также стабилизирует ряд белков, необходимых для роста опухоли, поэтому ингибиторы Hsp90 исследуются как противораковые лекарственные средства.
| Гистидин киназа-, ДНК-гираза B-, и АТФ-Hsp90 | |
|---|---|
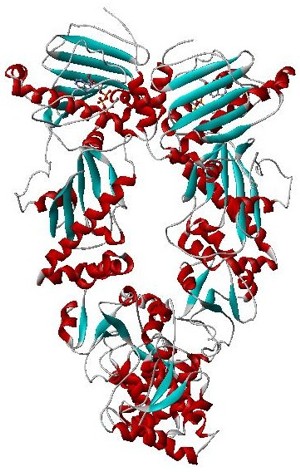
 Твёрдая ленточная модель дрожжевого Hsp90-димера (α-спирали = красный, β-листы = голубой, петли = серый) в комплексе с АТФ (красная палочка).[1] | |
| Идентификаторы | |
| Символ | HATPase_c |
| Pfam | PF02518 |
| Pfam clan | CL0025 |
| InterPro | IPR003594 |
| SMART | SM00387 |
| SCOP | 1ei1 |
| SUPERFAMILY | 1ei1 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
| Медиафайлы на Викискладе | |
Белки теплового шока, как класс, относятся к числу наиболее экспрессивных клеточных белков всех видов[3]. Как следует из их названия, белки теплового шока защищают клетки, когда они подвергаются воздействию повышенных температур. На них приходится 1-2 % от общего содержания белка, в не подверженных стрессу клетках. Однако, когда клетки нагреваются, доля белков теплового шока увеличивается до 4-6 % от общего содержания клеточных белков[4].
Белок теплового шока 90 (Hsp90) является одним из наиболее распространённых теплосодержащих белков. Название «90» происходит от того, что его молекулярная масса составляет около 90 килодальтон. Белок, имеющий массу 90 кДа считается довольно крупным для нефиброзных белков. Hsp90 встречается у бактерий и всех ветвей эукариот, но, по-видимому, отсутствует в археях[5]. В то время как цитоплазматический Hsp90 необходим для жизнеспособности при всех условиях у эукариот, бактериальный гомолог HtpG может применяться в условиях нетеплового стресса[6].
Впервые этот белок был изолирован путём извлечения белков из клеток, подвергшихся стрессу в результате нагревания, обезвоживания или других воздействий, в результате которых белки клетки начинали денатурировать[7]. Однако позже было обнаружено, что Hsp90 выполняет важные функции и в клетках, не подвергшихся стрессу.
Изоформы
Суммиров вкратце
Перспектива
Hsp90 является высококонсервативным и экспрессируется во множестве различных организмов от бактерий до млекопитающих, включая прокариотический аналог HtpG (высокотемпературный белок G) с 40 % идентичностью последовательностей и 55 % сходством с белком человека[5]. Hsp90 дрожжей на 60 % идентичны Hsp90α человека.
В клетках млекопитающих существуют два или более гена, кодирующих цитозольные гомологи Hsp90[5], с человеческим Hsp90α, имеющим 85 % идентичность последовательности с Hsp90β[8]. Предполагается, что α- и β-формы являются результатом события дублирования генов, произошедшего миллионы лет назад[5].
Пять функциональных человеческих генов, кодирующих изоформы белков Hsp90, представлены в виде таблицы[8]:
| семейство | внутриклеточная локализация | подсемейство | ген | семейство |
|---|---|---|---|---|
| HSP90A | цитоплазматический | HSP90AA (индуцируемый) |
HSP90AA1 | Hsp90-α1 |
| HSP90AA2 | Hsp90-α2 | |||
| HSP90AB (конститутивно экспрессируемый) |
HSP90AB1 | Hsp90-β | ||
| HSP90B | эндоплазматический ретикулум | HSP90B1 | Эндоплазмин/ GRP-94 | |
| TRAP | митохондриальный | TRAP1 | белок, ассоциированный с TNF1 |
Существует 12 человеческих псевдогенов (нефункциональных генов), которые кодируют дополнительные изоформы Hsp90, они не экспрессируются в виде белков.
Недавно был идентифицирован связанный с мембраной цитозольный вариант Hsp90, у которого отсутствовал сайт связывания АТФ, и был назван Hsp90N[9]. Этот транскрипт HSP90α-Δ-N представляет собой химеру с первой 105 п.н. кодирующей последовательности, полученной из гена CD47 на хромосоме 3q13.2, и оставшуюся кодирующую последовательность, полученную из HSP90AA1[8]. Однако позже было установлено, что ген, кодирующий Hsp90N не существует в геноме человека. Это, возможно, артефакт клонирования или продукт хромосомной перегруппировки, происходящий в одной клеточной линии[10].
Структура
Суммиров вкратце
Перспектива




Общая структура
Общая структура Hsp90 аналогична общей структуре других белков, поскольку она содержит все общие вторичные структурные элементы (например, альфа-спирали, бета-листы и случайные клубки). Будучи цитоплазматическим белком, Hsp90 является глобулярным по структуре, который в основном состоит из остатков неполярных аминокислот внутри и полярных снаружи, данное свойство позволяет взаимодействовать с водой. Hsp90 содержит девять спиралей и восемь антипараллельных бета-листов, которые объединяются, формируя несколько альфа/бета сэндвичных структур. 310-спиралей составляют примерно 11 % аминокислотных остатков белка, что намного выше, в среднем на 4 %, чем в других белках[11].
Доменная структура
Hsp90 состоит из четырёх структурных доменов[12][13][14]:
- высококонсервативный N-концевой домен (NTD) ~ 25 кДа
- область так называемого «заряженного линкера», которая соединяет N-конец со средним доменом
- средний домен (MD) ~ 40 кДа
- С-концевой домен (CTD) ~ 12 кДа.
Кристаллические структуры доступны для N-концевого домена дрожжей и Hsp90 человека[2][15][16], для комплексов N-конца с ингибиторами и нуклеотидами и для среднего домена дрожжей Hsp90[15][16][17]. Недавно были выяснены полные длины структур белков Hsp90 из E. coli (2IOP, 2IOQ)[18], дрожжей (2CG9, 2CGE)[19], и эндоплазматического ретикулума собаки (2O1U, 2O1V)[20][21].
Hsp90 образует гомодимеры, где локальные контакты расположены внутри С-конца при открытой конформации димера. N-концы также контактируют в замкнутой конформации димера[17].
N-терминальный домен
N-терминальный домен имеет гомологию не только среди членов семейства шаперонов Hsp90, но также и среди членов суперсемейства АТФазы/GHKL киназы (сокр. от Gyrase, Hsp90, Histidine Kinase, MutL)[13].
Обычный связывающий карман для АТФ и ингибитора гелданамицина расположен в N-концевом домене[15][16]. Аминокислоты, которые непосредственно участвуют в взаимодействии с АТФ, являются Leu34, Asn37, Asp79, Asn92, Lys98, Gly121 и Phe124. Кроме того, ионы Mg2+ и несколько молекул воды образуют мостиковые взаимодействия, посредством электростатического и водородного связывания, соответственно, между молекулами Hsp90 и AТФ. Кроме того, остаток Glu33 необходим для гидролиза АТФ.
Средний домен
Средний домен разделен на три области:
- 3-слойный α-β-α сэндвич
- 3-оборотная α-спираль и нерегулярные петли
- 6-оборотная α-спираль[13].
Средний домен (MD) также участвует в связывании с белком клиента. Например, белки, которые, как известно, взаимодействуют с данным MD Hsp90, включают PKB/Akt1, eNOS[22][23], Aha1, Hch1. Кроме того, известно, что связывание субстрата (например, Aha1 и Hch1) с MD также увеличивает активность АТФазы Hsp90[17][24].
C-терминальный домен
С-концевой домен обладает альтернативным сайтом связывания АТФ, который становится доступным, когда занят карман Бержерата N-конца белка[25][26].
На С-терминальном конце белка расположен сайт распознавания мотивов тетратрипептидного повтора (TPR), консервативный пентапептид MEEVD, который отвечает за взаимодействие с кофакторами, такими как иммунофилины FKBP51 и FKBP52, индуцированный стрессом фосфопротеин 1 (Sti1/Hop), циклофилин-40, PP5, Tom70 и многие другие[27].
Молекулярный механизм
Суммиров вкратце
Перспектива
Белок Hsp90 содержит три функциональных домена: АТФ-связывающий, белок-связывающий и димеризующий домен, каждый из которых играет решающую роль в функционировании белка.
АТФ-связывающий домен
В районе N-конца белка находится высокоаффинный АТФ-связывающий участок. АТФ связывается со значительной расщелиной в боковой части белка, глубина которой составляет 15 Å (1,5 нанометра). Эта расщелина обладает высоким сродством к АТФ, и при получении подходящего белкового субстрата Hsp90 расщепляет АТФ на АДФ и Фi. Прямые ингибиторы связывания АТФ или аллостерические ингибиторы либо связывания АТФ, либо АТФазной активности могут блокировать функцию Hsp90[11]. Ещё одна интересная особенность АТФ-связывающей области Hsp90 заключается в том, что она имеет "крышку", которая открыта в АДФ-связанном состоянии и закрыта в АТФ-связанном состоянии[28]. В открытой конформации крышка не имеет внутрибелкового взаимодействия, а в закрытой конформации контактирует с несколькими остатками[29]. Вклад этой крышки в активность Hsp90 был исследован с помощью сайт-направленного мутагенеза. Мутант Ala107Asp, стабилизирующий закрытую конформацию белка за счёт образования дополнительных водородных связей, существенно повышает АТФазную активность, оставляя конформацию AMP+PnP неизменной[29].
В настоящее время АТФаза-связывающая область Hsp90 интенсивно изучается, поскольку она является основным местом связывания лекарств, нацеленных на этот белок[30]. Противоопухолевые препараты, нацеленные на этот участок Hsp90, включают антибиотики гелданамицин[11][31], гербимицин, радицикол, дегуелин[32], деррубон,[33], макбецин[34], и бета-лактамы[35].
Белок-связывающий домен
Белок-связывающая область Hsp90 расположена на С-конце аминокислотной последовательности. Белок Hsp90 может принимать два основных конформационных состояния. Первое — это открытое АТФ-связанное состояние, а второе — закрытое АДФ-связанное состояние. Таким образом, гидролиз АТФ приводит к так называемому "клещевому" конформационному изменению сайта связывания белка[36].
Hsp90, находясь в открытой конформации, оставляет некоторые гидрофобные остатки открытыми, к которым с высоким сродством присоединяются развёрнутые и неправильно уложенные белки, имеющие необычные гидрофобные участки[37]. Когда связанный субстрат находится на месте, гидролиз АТФ, высвобождающий энергию благодаря функции АТФазы вблизи N-концевого домена, приводит к конформационным изменениям, которые фиксируют Hsp90 на субстрате[29]. В реакции, аналогичной реакции других молекулярных белков-зажимов, таких как GyrB и MutL, этот сайт управляет практически всеми функциями сворачивания белков, в которых участвует Hsp90. В отличие от этого, MutL и GyrB функционируют как топоизомеразы и используют зарядовый зажим с большим количеством положительно заряженных боковых цепей, которые электростатически притягиваются к отрицательно заряженной основе ДНК[38].
Способность Hsp90 прикрепляться к белкам позволяет ему выполнять несколько функций, в том числе помогать фолдингу (укладке, сворачиванию), предотвращать агрегацию и облегчать транспорт.
Выполняемые функции
Суммиров вкратце
Перспектива
В нормальных клетках
В клетках, не подверженных стрессу Hsp90 играет ряд важных ролей, которые включают в себя помощь в фолдинге, внутриклеточном переносе, поддержании и деградации белков, а также в облегчении клеточной сигнализации.
Фолдинг белка и роль шаперона
Известно, что Hsp90 ассоциируется с ненативными структурами многих белков, это привело к предложению, что Hsp90 участвует в фолдинге белка вообще[39]. Было показано, что Hsp90 подавляет агрегацию широкого спектра «клиентских» или «субстратных» белков и, следовательно, действует как общий защитный шаперон[40][41][42]. Однако Hsp90 несколько более селективный (избирательный), чем другие шапероны[43].
Деградация белков
Эукариотические белки, которые больше не нужны или неправильно свёрнуты или повреждены иным образом, обычно маркируются для деструкции (разрушения) путём полиубиквитинирования. Эти убиквитиновые белки распознаются и деструктурируются с помощью 26S протеасом[44][45]. Следовательно, 26S-протеасомы являются неотъемлемой частью механизма деградации белков клетки. Кроме того, для поддержания третичной структуры протеасомы необходим постоянный источник функционального Hsp90[46]. Наконец, эксперименты с теплочувствительными мутантами Hsp90 и протеасомами 26S предполагают, что Hsp90 ответственен за большинство, если не все, активности АТФазы протеасом[44].
Взаимодействие со стероидными рецепторами

Глюкокортикоидный рецептор (GR) является наиболее тщательно изученным примером стероидного рецептора, функция которого в решающей степени зависит от взаимодействия с Hsp90[48][49]. В отсутствие кортизола — стероидного гормона, GR находится в цитозоле, в образованном комплексе с несколькими белками-шаперонами, включая Hsp90 (см. Рисунок справа). Эти шапероны поддерживают ГР в состоянии, способном связывать гормон. Вторая роль Hsp90 заключается в связывании иммунофилинов (например, FKBP52), которые присоединяют комплекс GR к пути распространения белка динеина, который транслоцирует (переносит) активированный рецептор из цитоплазмы в клеточное ядро[50]. Один раз в ядре GR димеризуется и связывается с определёнными последовательностями ДНК и тем самым усиливает экспрессию GR-чувствительных генов. Hsp90 также необходим для правильного функционирования ряда других стероидных рецепторов, в том числе ответственных за связывание альдостерона[51], андрогена[52], эстрогена[53] и прогестерона[54].

Опухолевые клетки
Злокачественные клетки сверхэкспрессируют ряд белков, включая рецепторы фактора роста, такие как EGFR или белки трансдукции сигнала, такие как PI3K и AKT (ингибирование данных белков может вызвать апоптоз). Hsp90 стабилизирует различные рецепторы фактора роста и некоторые сигнальные молекулы, включая PI3K и AKT-белки. Следовательно, ингибирование Hsp90 может индуцировать апоптоз посредством ингибирования сигнального пути PI3K/AKT и сигналов фактора роста в целом.
Интересно, что разрушение молекул HSP90 с помощью нанотерапевтических средств было направлено на борьбу с резистентностью, вызванной лекарственными препаратами, и снимает подавление иммунных клеток естественных киллеров (NK) при раке молочной железы[56]. Ещё одна важная роль Hsp90 в канцерогенезе — стабилизация мутантных белков, таких как v-Src, слияния онкогенов Bcr/Abl и мутантных форм p53, которые появляются при трансформации клеток. По-видимому, Hsp90 может выступать в роли "защитника" менее стабильных белков, образующихся в результате мутаций ДНК[57].
Hsp90 также необходим для индукции фактора роста эндотелия сосудов (VEGF) и синтазы оксида азота (NOS)[23]. Оба фактора важны для ангиогенеза de novo, который необходим для роста опухоли за пределом диффузионного расстояния кислорода в тканях[57]. Он также способствует инвазии на этапе метастазирования, помогая матриксной металлопротеиназе MMP2[58]. Вместе со своими ко-шаперонами Hsp90 модулирует апоптоз опухолевых клеток "через влияние на AKT[22], рецепторы фактора некроза опухоли (TNFR) и функцию ядерного фактора-κB (NF-κB)[59]". Кроме того, Hsp90 участвует во многих ключевых процессах онкогенеза, таких как самоподдержание сигналов роста, стабилизация мутантных белков, ангиогенез и метастазирование.
Клиническое значение
Суммиров вкратце
Перспектива
Hsp90 играет явно противоречивые роли в клетке, поскольку он важен как для создания и поддержания, так и для деградации белков. Его нормальная функция имеет решающее значение для поддержания здоровья клеток, тогда как его нарушение регуляции может способствовать канцерогенезу. Способность этого шаперона как стабилизировать протеасому 26S (что позволяет клетке разрушать нежелательные и/или вредные белки), так и стабилизировать киназы против одной и той же протеасомы демонстрирует его функциональное разнообразие. Использование ингибиторов Hsp90 в лечении рака подчеркивает важность Hsp90 как терапевтической мишени[60].
Лекарственные препараты, нацеленные на Hsp90, показали многообещающий эффект в клинических испытаниях. Например, ингибитор Hsp90 гелданамицин был использован в качестве противоопухолевого средства[11]. Первоначально считалось, что препарат функционирует как ингибитор киназы, но впоследствии было показано, что он является ингибитором Hsp90, где он использует компактную конформацию для вставки в сайт связывания АТФ[11].
HSP90β был идентифицирован как один из аутоантигенных биомаркеров и мишеней, вовлечённых в аутоиммунное заболевание яичников человека, приводящее к отказу яичников и, следовательно, бесплодию[61].
Предсказание и валидация иммунодоминантного эпитопа/ов белка HSP90β были продемонстрированы на примере сывороток бесплодных женщин, имеющих анти-HSP90 аутоантитела. Декапептид EP6 (380-389) является основным иммуногенным эпитопом HSP90, за ним следуют EP1 (1-12) и EP8 (488-498). Знание эпитопов, связывающих аутоантиген, необходимо для понимания последующих патологических событий. Предсказанные 3D-структуры этих пептидов показали, что они существуют в конформации петли, которая является наиболее подвижной частью белка. Кроме того, анализ последовательностей HSP90β у нескольких видов показывает, что пептид EP6 входит в состав хорошо сохраняемого мотива. Поликлональное антитело, созданное к иммунодоминантному эпитопу EP6, подтверждает сходную биохимическую и клеточную иммунореактивность, наблюдаемую в сыворотках пациентов с анти-HSP90 аутоантителами. Данное исследование может создать новые инструменты для обнаружения эпитопов, вызывающих заболевания, и возможного терапевтического вмешательства[62].
Эволюция
Суммиров вкратце
Перспектива
Выравнивание последовательностей Hsp90 показало, что белок имеет около 40 % идентичности последовательностей среди всех гомологов, что указывает на его высокую консервативность. Существует два гомолога, обнаруженных в цитозоле и эндоплазматическом ретикулуме соответственно. Присутствие этих двух гомологов, вероятно, было вызвано дупликацией (удвоением) генов на ранних этапах эволюции эукариот, которая могла сопровождаться развитием эндоплазматического ретикулума или ядра. В пользу этого предположения говорит тот факт, что дупликация обнаружена у Giardia lamblia, одного из самых ранних ветвящихся видов эукариот. Впоследствии произошло еще как минимум 2 дупликации генов, что объясняет различные формы Hsp90, встречающиеся у грибов и позвоночных. Одна дивергенция привела к появлению когнатных и термоиндуцируемых форм Hsp90 в Saccharomyces cerevisiae, а второе событие дупликации генов в цитозольной ветви привело к появлению альфа- и бета-подсемейств последовательностей, которые встречаются у всех позвоночных. В филогенетическом древе, основанном на последовательностях Hsp90, было обнаружено, что растения и животные более тесно связаны друг с другом, чем с грибами[63]. Подобно белку Hsp90, ген белка Hsp70 также подвергся дупликации на очень ранней стадии формирования эукариотических клеток, и гомологи в цитозоле и эндоплазматическом ретикулуме появились в результате этого события дупликации генов[64]. Эти события дупликации генов важны с точки зрения происхождения эукариотической клетки и эндоплазматического ретикулума[65][66].
Примечания
Wikiwand - on
Seamless Wikipedia browsing. On steroids.