Loading AI tools
Из Википедии, свободной энциклопедии
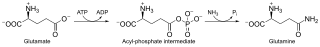
Глутаминсинтетаза, также L-глутамат-аммиак лигаза (сокр. ГС) — фермент (КФ 6.3.1.2)[3] из класса синтетаз (лигаз), принимает участие в обезвреживании свободного аммиака в тканях. Данный фермент катализирует в присутствии двухвалентных ионов (Mg2+ или Mn2+) реакцию образования аминокислоты L-глутамина, посредством присоединения к L-глутамату молекул аммиака NH3 (in vivo свободный аммиак ионизирован и представляет собой катион аммония — NH4+), с использованием энергии гидролиза макроэргических связей АТФ. Реакция имеет следующий вид:
| L-глутамат-аммиак лигаза | |
|---|---|
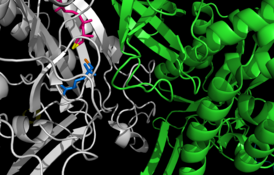 Активный центр между двумя мономерами глутаминсинтетазы Salmonella typhimurium. Сайты связывания катионов окрашены в жёлтый и оранжевый цвета; АДФ — розовый; фосфинотрицин (необратимый ингибитор) имеет синий цвет.[1] | |
| Идентификаторы | |
| Шифр КФ | 6.3.1.2 |
| Номер CAS | 9023-70-5 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9023-70-5 |
| Глутаминсинтетаза, каталитический домен | |
|---|---|
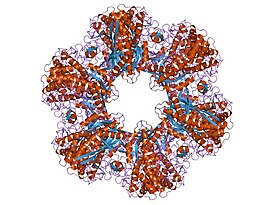 12-субъединичный фермент глутаминсинтетаза из Salmonella typhimurium.[2] | |
| Идентификаторы | |
| Символ | Gln-synt_C |
| Pfam | PF00120 |
| Pfam clan | CL0286 |
| InterPro | IPR008146 |
| PROSITE | PDOC00162 |
| SCOP | 2gls |
| SUPERFAMILY | 2gls |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
L-глутамат + ATФ + NH3 → L-глутамин + АДФ + Фi.
Глутаминсинтетаза использует в качестве субстрата аммиак (точнее ионы аммония), образующийся в результате восстановления нитратов, расщепления аминокислот и фотодыхания[4](у растений). Амидная группа глутамата является источником азота для синтеза метаболитов глутаминового пути[5](например, для синтеза пиримидиновых азотистых оснований).
Конкуренция между ионом аммония и водой, их сродство к связыванию и концентрация иона аммония влияют на синтез глутамина и его гидролиз. Глутамин образуется, если ион аммония атакует ацилфосфатный промежуточный продукт, в то же время, если вода атакует молекулы интермедиата, то происходит образование глутамата[6][7]. Ион аммония связывается с ГС сильнее, чем вода, из-за электростатических сил между катионом и отрицательно заряженным карманом[4]. Другая возможная реакция заключается в том, что при связывании гидроксиламина NH2OH с ГС, а не с ионом NH4+, образуется γ-глутамилгидроксамат[6][7].
Глутаминсинтетаза широко распространена в живых организмах и встречается как у прокариот, так и у эукариот. Прокариотические типы глутаминсинтетазы локализованы в цитозоле клеток, в то же время эукариотические типы фермента могут располагаться как в цитозоле, так и в органеллах (в митохондриях или хлоропластах). Несмотря на то, что данный фермент обнаружен в матриксе митохондрий, ГС — не является митохондриальным белком, он транслоцируется в матрикс обычно из цитозоля.
У человека ГС кодируется геном — GLUL, который локализован на q-плече 1-й хромосомы. Длина полипептидной цепи белка составляет 373 аминокислотных остатков, его молекулярная масса — 42064 Да[8]. Белок имеет 2 домена: первый домен — некаталитический (β-grasp), включает аминокислоты 24-106, второй — каталитический, включает в себя аминокислоты 113-373.
Глутаминсинтетаза представляет собой олигомерный белок и может состоять из 8, 10 или 12 идентичных субъединиц, разделённых на два обращённых друг к другу кольца[6][9][10][11]. Бактериальные ГС представляют собой додекамеры (12-меры) с 12 активными центрами между каждым мономером[6]. Каждый активный сайт создаёт «туннель», который является местом расположения трёх различных сайтов связывания субстрата: нуклеотида, иона аммония (NH4+) и аминокислоты[4][6][11][12]. Молекулы АТФ связываются с верхушкой двойной воронки, которая открывается на внешнюю поверхность ГС. Глутамат связывается в нижней части активного сайта[7]. В середине двойной воронки имеются два места связывания двухвалентных катионов (Mn+2 или Mg+2). Один сайт связывания катионов участвует в фосфорильном переносе АТФ на глутамат, а второй стабилизирует активность ГС и помогает связыванию глутамата[6].
Два кольца ГС удерживаются вместе за счёт водородных связей и гидрофобных взаимодействий. В своей последовательности каждая субъединица имеет С-конец и N-конец. С-конец (спиральный ремешок) стабилизирует структуру глутаминсинтетазы, встраиваясь в гидрофобную область субъединицы поперёк другого кольца. N-конец подвергается воздействию растворителя. Кроме того, центральный канал формируется за счёт шести четырёхцепочечных β-листов, состоящих из антипараллельных петель двенадцати субъединиц[6].

Фермент катализирует АТФ-зависимую конденсацию глутамата с аммиаком с образованием глутамина[4]. Гидролиз молекул АТФ запускает первый этап двухступенчатого согласованного механизма[4][6]. АТФ фосфорилирует глутамат с образованием АДФ и промежуточного ацилфосфата — γ-глутамилфосфата, который реагирует с аммиаком, образуя глутамин и неорганический фосфат. АДФ и Фi не диссоциируют до тех пор, пока происходит связывания аммиака и не высвобождается глутамин[6].
АТФ сначала связывается с верхней частью активного сайта, расположенного рядом с сайтом связывания катионов, тогда как глутамат связывается со вторым сайтом связывания катионов в нижней части активного сайта[5][7]. Присутствие молекул АДФ вызывает конформационный сдвиг в молекуле фермента, который стабилизирует фрагмент γ-глутамилфосфата. Аммоний прочно связывается с ГС только в том случае, если присутствует промежуточный ацилфосфат. Аммоний, а не аммиак, связывается с ГС, поскольку сайт связывания полярен и подвергается воздействию растворителя[7]. На втором этапе депротонирование аммония позволяет аммиаку атаковать интермедиат из близлежащего участка с образованием глутамина[13]. Фосфат (Фi) уходит через верхнюю часть активного центра, а глутамин — через нижнюю часть (между двумя кольцами)[14][7].
ГС локализована преимущественно в головном мозге, почках и печени[4][11]. Глутаминсинтетаза в головном мозге участвует в метаболической регуляции глутамата, детоксикации аммиака (который очень токсичен для ЦНС), ассимиляции аммиака, рециклизации нейротрансмиттеров и прекращении сигналов нейромедиаторов[4][15]. ГС в головном мозге обнаруживается преимущественно в астроцитах[16]. Астроциты защищают нейроны от эксайтотоксичности, поглощая избыток аммиака и глутамата. В гипераммониемической среде (высокие концентрации аммиака) возникает отёк астроглии[15][17][18]. К проблеме набухания астроглии подошли с разных точек зрения. Одно исследование показывает, что происходят морфологические изменения, которые увеличивают экспрессию ГС в глутаматергических областях или другие адаптации, которые снижают высокие уровни глутамата и аммиака[15]. Другая точка зрения заключается в том, что набухание астроцитов происходит из-за накопления глутамина. Чтобы предотвратить повышение уровня коркового глутамата и содержания кортикальной воды, было проведено исследование по предотвращению активности ГС у крыс с помощью ингибитора — метионинсульфоксимина (MSO)[17].
По-видимому, существует три различных класса ГС:[19][20][21]
Растения имеют два или более изофермента GSII, один из изоферментов транслоцируется в хлоропласт. Другая форма — цитозольная. Цитозольная трансляция гена GS регулируется его 5'-нетранслируемой областью (5'-UTR), в то время как его 3'-UTR играет роль в смене транскриптов[24].
Хотя три класса глутаминсинтетаз явно структурно связаны, их сходство последовательностей не столь велико.
ГС подвержена обратимой ковалентной модификации. Аминокислотный остаток тирозина Tyr-397 из всех 12 субъединиц может подвергаться аденилированию или деаденилированию аденилаттрансферазой (AT), бифункциональным регуляторным ферментом[26]. Аденилирование — это посттрансляционная модификация белка, включающая ковалентное присоединение молекул АМФ к боковой цепи белка. Для каждого аденилирования требуется молекула АТФ, а для полного ингибирования ГС требуется 12 АТФ. Деаденилирование с помощью АТ включает фосфоролитическое удаление Tyr-связанных аденилильных групп в виде молекул АДФ. На активность АТ влияет связанный с ней регуляторный белок: PII, тример с молекулярной массой 44 кДа[26]. PII также подвергается посттрансляционной модификации уридилилтрансферазой, поэтому PII имеет две формы. Состояние белка PII влияет на активность аденилаттрансферазы. Если PII не уридилирован, то он примет форму PIIA. Комплекс AT:PIIA деактивирует ГС путём аденилирования. Если молекулы PII уридилированы, то они примут форму PIID. Комплекс AT:PIID активирует ГС путём деаденилирования[26]. Комплексы AT:PIIA и AT:PIID реципрокно (взаимно) аллостерически регулируются α-кетоглутаратом (α-KG) и глутамином (Gln). Gln активирует активность AT:PIIA и ингибирует AT:PIID, что приводит к аденилированию и последующей дезактивации ГС. Более того, Gln выступает за преобразование PIID в PIIA. Эффекты α-KG на комплексы противоположны[26]. У большинства грамотрицательных бактерий глутаминсинтетаза может модифицироваться путём аденилирования (некоторые цианобактерии и зелёные водоросли или исключения)[27].
Ингибирование ГС в основном сосредоточено на связывании сайтов амино лигандов[6]. Другие ингибиторы являются результатом метаболизма глутамина: триптофан, гистидин, карбамоилфосфат, глюкозамин-6-фосфат, цитидинтрифосфат (ЦТФ) и аденозинмонофосфат (АМФ)[5][9][28]. Другими ингибиторами/регуляторами являются аминокислоты глицин и аланин. Аланин, глицин и серин связываются с участком глутаматного субстрата. ГДФ, АМФ, АДФ связываются с сайтом АТФ[6]. L-серин, L-аланин и глицин связываются с сайтом L-глутамата в неаденилированной глутаминсинтетазе. Четыре аминокислоты связываются с этим участком своими общими атомами, “главной цепью” аминокислот[5]. Глутамат — ещё один продукт метаболизма глутамина; однако глутамат является субстратом для ингибирования ГС, который действует как регулятор ГС. Каждый ингибитор может снижать активность фермента; как только все конечные метаболиты глутамина связываются с ферментом, его активность почти полностью ингибируется[9]. Множество ингибирующих входных сигналов позволяет осуществлять тонкую регуляцию ГС, отражая уровень азота в организме.
Регуляция обратной связи определяет разницу между двумя эукариотическими типами ГС: мозговым типом (ткани мозга) и немозговым (все остальные ткани). Немозговой тип ГС реагирует на подавление обратной связи конечным продуктом, в то время как мозговой тип ГС этого не делает[6]. Высокие концентрации глутамин-зависимых метаболитов должны подавлять активность ГС, в то время как низкие концентрации должны активировать активность ГС.

Ингибиторы:
Исследования на E. coli показали, что глутаминсинтетаза регулируется посредством экспрессии генов. Ген, кодирующий субъединицу ГС, обозначается glnA. Транскрипция glnA зависит от NRI (специфического усилителя транскрипции). Активная транскрипция происходит, если NRI находится в своей фосфорилированной форме, обозначаемой NRI-P. Фосфорилирование NRI катализируется NRII, протеинкиназой. Если NRII образует комплекс с PIIA, то он будет функционировать как фосфатаза, и NRI-P преобразуется обратно в NRI. В этом случае транскрипция glnA прекращается[26].
ГС подчиняется совершенно иным регуляторным механизмам у цианобактерий[29]. Вместо обычной двухкомпонентной системы NtrC-NtrB[30][31], цианобактерии содержат регулятор транскрипции NtcA, который ограничен этой кладой и контролирует экспрессию ГС и множества генов, участвующих в метаболизме азота[32][33]. Более того, глутаминсинтетазы у цианобактерий ковалентно не модифицируется чтобы повысить чувствительность к ингибированию по принципу обратной связи[31]. Вместо этого, ГС у цианобактерий ингибируются небольшими белками, которые называются ГС-инактивирующими факторами (IFs), транскрипция которых отрицательно регулируется NtcA[34][35]. Кроме того, эти инактивирующие факторы регулируются различными некодирующими РНК: sRNA NsiR4 взаимодействует с 5'-UTR мРНК фактора инактивации ГС IF7 (мРНК gifA) и снижает его экспрессию. Экспрессия NsiR4 находится под положительным контролем транскрипционного фактора, отвечающего за регуляцию азота, NtcA[36]. Кроме того, экспрессия фактора, инактивирующего ГС, IF17 контролируется глутамин-связывающим рибопереключателем[37].
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.